(1)解説授業動画
☆YouTubeチャンネルの登録をよろしくお願いします→大学受験の王道チャンネル
(2)解説授業の原稿
弱酸の性質によって起きる現象である、塩の加水分解と弱酸遊離について解説します。
弱酸と弱塩基の定義
まずは弱酸と弱塩基の定義を確認します。
強酸と強塩基の定義
弱酸と弱塩基の定義を知るためには強酸と強塩基の定義を確認する必要があります。
強酸と強塩基は電離度がほぼ1の酸や塩基のことです。電離度が1であるということは100%電離するということであり、例えば塩酸であれば、HClはすべてH+とCl-に電離します。
HCl → H++Cl-
そして水溶液中では、H+とCl-がくっついてHClになるということはあり得ません。そのため水溶液中ではHClとして存在することができないということにもなります。
ちなみに強酸は塩酸(HCl)と硫酸(H2SO4)と硝酸(HNO3)の3つを覚えましょう。
また、強塩基は水酸化ナトリウム(NaOH)や水酸化カリウム(KOH)といったアルカリ金属の水酸化物や、水酸化カルシウム(Ca(OH)2)や水酸化バリウム(Ba(OH)2)といったアルカリ土類金属の水酸化物であるということは知っておきましょう。
弱酸と弱塩基の定義
そしてこれら以外の酸や塩基は、基本的に全て弱酸と弱塩基になります。
したがって、弱酸と弱塩基の定義は電離度が1ではない酸と塩基ということになります。通常、問題で扱う弱酸と弱塩基の電離度は、0.02や0.01といった1よりもかなり小さいものを扱うほどがほとんどです。
弱酸・弱塩基の電離
そのため、酢酸が水溶液中で以下のように電離するのはごく一部であり、むしろほとんどの酢酸が電離しないまま水溶液中に残っています。
CH3COOH ⇄ CH3COO-+H+
そのため化学反応式の矢印は、右向きだけではなく左向きも書かないといけません。
これが弱酸と弱塩基の定義です。
- 化学反応式の矢印が⇄の状態を「化学平衡」の状態といいます。化学平衡に関してはこちら→化学平衡の基本(化学平衡とは何か、可逆反応・不可逆反応、グラフの読み取り、平衡定数の定義、化学平衡の法則・質量作用の法則)
弱酸と弱塩基の性質
それでは弱酸と弱塩基の定義が確認できたところでそれをふまえて弱酸と弱塩基の性質を考えてみます。
元に戻ろうとする力が強い
弱酸と弱塩基は先ほども確認した通り、電離度が1よりもかなり小さいので電離する力はとても弱いです。
しかしそれは言い換えると、「元に戻ろうとする力が強い」ということになります。弱酸と弱塩基は「弱」という漢字が入っているので弱いというイメージばかり持ってしまいがちですが、見方を変えてみると「実は強い」という認識を持つことが、塩の加水分解や弱酸遊離といった現象を考える上で重要になります。
「元に戻ろうとする力」は「水素イオンや水酸化物イオンと結びつく力」と言い換えることもできます。
酢酸の電離と量的関係
例えば、酢酸は以下のように電離するのですが、
CH3COOH ⇄ CH3COO-+H+
電離度がとても小さいので、量的な関係は下図の左のようなイメージになります。
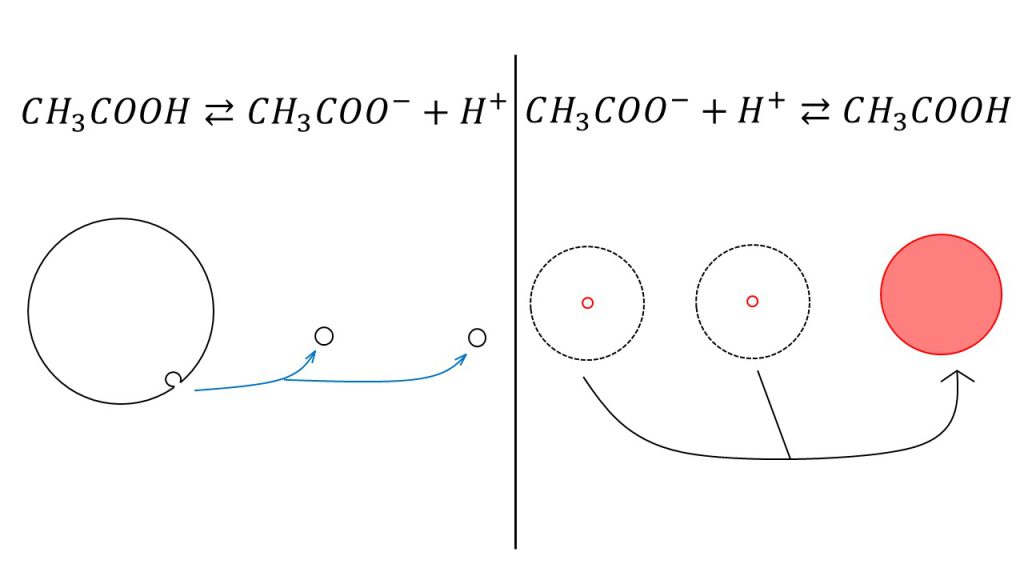
酢酸のごく一部が酢酸イオンと水素イオンに電離します。
しかし、例えば酢酸イオンがある程度存在している水溶液に水素イオンを投入してみると、酢酸イオンは「元に戻ろうとする力」つまり「水素イオンと結びつく力」が強いので、投入された水素イオンのほとんどと結びついて酢酸になります(図の右)。
このようにしてみると弱酸が実は強い力を持っているということがイメージできると思います。
それではこの弱酸と弱塩基は弱いがゆえに実は強いという認識を持って、塩の加水分解と弱酸(弱塩基)遊離の2つの現象を考えてみましょう。
塩の加水分解の原理
まずは塩の加水分解の原理を考えていきましょう。
塩の加水分解の原理を正しく理解することが出来れば、「なぜ弱酸と強塩基を中和したときの中和点は塩基性よりになるのか」という問いに正しく応えることができるようになります。ちなみに「塩基のほうが強いから塩基が勝って塩基性になる」というような答え方をする人がいますが、それは本質的な答えではありません。
酢酸と水酸化ナトリウムの中和
それでは、塩の加水分解を酢酸と水酸化ナトリウムの中和を例に考えていきます。
まずは、酢酸と水酸化ナトリウムが中和して、塩である酢酸ナトリウムと水ができます。
CH3COOH + NaOH → CH3COONa + H2O
酢酸は弱酸で水酸化ナトリウムは強塩基ですが、中和反応に関しては弱でも強でも関係なく、水素イオンと水酸化物イオンがなくなるまで反応が進行します。
酢酸ナトリウムの電離
そして次に、塩である酢酸ナトリウムが電離します。
CH3COONa → CH3COO-+ Na+
「塩は、例外を除いて水溶液中ではほぼ100%電離する」ということは知っておきましょう。そのためこの反応も逆の矢印は書いてはいけません。ちなみに、例外である水溶液中で電離をしない塩は、沈殿を形成する塩として無機化学で学習します。
- 沈殿を形成する塩に関してはこちら→イオン分析に必要な知識一覧
塩である酢酸ナトリウムは、水溶液中で酢酸イオンとナトリウムイオンに完全に電離します。したがって、今水溶液中には酢酸イオンとナトリウムイオンが存在します。
このうちナトリウムイオンは強塩基のイオンなので、水溶液中でこれ以上何も反応はしません。「電離度が大きい」ということは「水溶液中で他のイオンと結びつきにくい」ということを表しているのです。
酢酸イオンが酢酸に戻ろうとする
そして、酢酸イオンは弱酸のイオンなので元に戻ろうとする力が強く、水素イオンと結びつこうとします。しかし、すでに中和は終わっているので酢酸イオンの周りに水素イオンは存在しません。
そこでどうするかというと、水が持っている水素イオンを無理やり奪い取って元の酢酸に戻ろうとします。
CH3COO- + H2O ⇄ CH3COOH + OH-
結果、水素イオンを奪われた水は水酸化物イオンとなり、水溶液中に水酸化物イオンがあるので酢酸ナトリウムを含む水溶液は塩基性となるのです。
この3番目の反応のことを塩の加水分解といいます。このように塩の加水分解は、弱酸の元に戻ろうとする力が強いという性質によって引き起こされている現象なのです。
水の電離
ちなみにこの水はこのように電離をしているわけですが、
H2O ⇄ H+ + OH-
水の電離というのはごくわずかしか起きません。しかし、ごくわずかしかない水素イオンすらも酢酸イオンは奪い取って元に戻ろうとしているのです。
このように水の電離はごくわずかなので、発生する水酸化物イオンの量もごくわずかであり、塩基性になるといっても大きく塩基性になることはなく、中和点よりもわずかに塩基生によるだけであるということは注意しておきましょう。
弱酸遊離の原理
次は同様に考えることによって弱酸遊離の原理を理解していきましょう。
弱酸遊離とは
そもそも弱酸遊離とは、弱酸の塩に強酸を加えると弱酸が遊離つまり発生する現象のことです。
例えば酢酸ナトリウムに塩酸を加えると酢酸が生じます。
CH3COONa + HCl → CH3COOH + NaCl
酢酸は弱酸なので酢酸ナトリウムは弱酸の塩です。それに塩酸という強酸を加えることで弱酸である酢酸が生じます。
よく弱酸遊離や弱塩基遊離のことを「追い出し反応」といいます。つまり強い強酸が弱い弱酸を追い出している反応ということなのですが、これは本質的ではありません。
なぜこれが本質的ではないのかを理解するために、この反応も順番に考えていきます。
酢酸ナトリウムと塩酸の電離
まず酢酸ナトリウムは塩なので100%電離して酢酸イオンとナトリウムイオンになります。
CH3COONa → CH3COO- + Na+
また塩酸は強酸なので、こちらも100%電離して水素イオンと塩化物イオンに分かれます。
HCl → H+ + Cl-
こうなると水溶液中には酢酸イオン、ナトリウムイオン、水素イオン、塩化物イオンの4種類のイオンが存在することになります。
このうち、ナトリウムイオンは強塩基のイオンなのでこれ以上何か反応することはありません。また、塩化物イオンも強酸のイオンなのでやはりこれ以上何か反応することはありません。
酢酸イオンが酢酸に戻ろうとする
しかし、酢酸イオンは弱酸のイオンなので元に戻ろうとする力が強く、水素イオンと結びつこうとします。
すると今回は水素イオンが存在しているので、酢酸イオンは水素イオンと結びついて酢酸になるのです。
CH3COO- + H+ → CH3COOH
これが弱酸遊離の原理です。
つまりこの反応の主役は、強酸ではなく弱酸なのです。弱酸の「元に戻ろうとする力」つまり「水素イオンと結びつこうとする力が強い」という性質によって引き起こされる現象なのです。
ゆえに強酸による「追い出し反応」というよりは、弱酸による「元に戻ろうとする反応」あるいは「水素イオンと結びつこうとする反応」が本質なのです。
ちなみに化学反応式では、以下のように書きますが、実際は水溶液中でNaClが存在することは無く、Na+とCl-といったイオンの状態で存在しています。
CH3COONa + HCl → CH3COOH + NaCl
いかがだったでしょうか。塩の加水分解と弱酸遊離が弱酸の性質によって起きているということが理解できたでしょうか。なお今回は弱酸で説明しましたが弱塩基でも同様に説明することができます。
(3)解説授業の内容を復習しよう
(4)中和と塩の解説一覧
②塩の加水分解と弱酸遊離の原理(弱酸の性質によって起きる現象)
③中和の計算を極める問題(複数の反応を扱った問題の解法、弱酸(弱塩基)遊離→逆滴定)
④pHの計算(対数を使った計算、pOHとの関係、水のイオン積Kwについても解説しています)
⑤塩の水溶液の液性(硫酸水素カリウムの水溶液の液性が酸性になる理由についても解説しています)
(5)電離平衡の解説一覧
①電離平衡の基本(弱酸・弱塩基の電離度とpHを求めます。近似についても解説しています)
②電離平衡で考える塩の加水分解(「塩の加水分解は存在しない」と言える理由、計算の進め方、水のイオン積についても解説しています)
③緩衝液①(緩衝液とは何か、緩衝液のイメージ、緩衝液の計算方針について解説しています)
④緩衝液②(緩衝液の計算、緩衝液に酸を加えたときのpHの計算)
(6)参考
☆化学の解説動画・授業動画一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識テスト一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学の解説・授業・知識・演習問題一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
