(1)解説授業動画
☆YouTubeチャンネルの登録をよろしくお願いします→大学受験の王道チャンネル
(2)解説授業の原稿
問題①(緩衝作用が働く前の緩衝液のpHを求める)
それではこの問題を解いていきましょう。
酢酸ナトリウムと酢酸を5.0×10-2molずつ溶かした水溶液の1.0LのpHを求めよ。ただし酢酸の電離定数Ka=1.8×10-5mol/Lとし、求めるpHは小数第2位までで答えます。さらにlog102=0.30、log103=0.48とし、今回の水溶液の体積は常に1.0Lで変わらないものとする。
つまり、この問題は緩衝作用が働く前の緩衝液のpHを求めてみようという問題です。それでは答案を作っていきます。
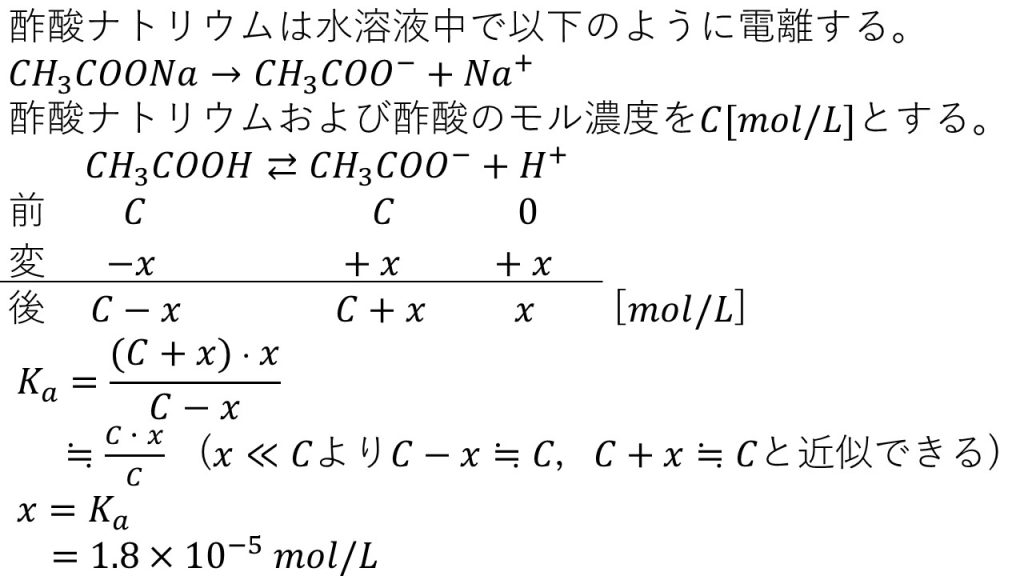
まず酢酸ナトリウムは塩なので、100%電離して酢酸イオンとナトリウムイオンになります。このことを踏まえて酢酸の電離の表を作ります。平衡に達する前の酢酸のモル濃度をC[mol/L]とし、平衡に達した後の水素イオン濃度をx[mol/L]とします。この酢酸のモル濃度は、今回は5.0×10-2mol/Lなので、Cのところを5.0×10-2としても構いません。ただ、今回は一般的に式を作りたかったのでCと置きました。
それでは表を確認していきます。まずは反応前ですが、反応前の酢酸のモル濃度はCで、反応前の酢酸イオンのモル濃度もCです。そして反応前の水素イオンのモル濃度は0です。この反応前の酢酸イオンのモル濃度が0となっていないのが、通常の電離平衡の問題とは違う点です。今回なぜCになるのかというと、酢酸ナトリウムと酢酸のモル濃度は同じCであり、酢酸ナトリウムは全て電離して酢酸イオンとなるので、酢酸イオンのモル濃度もCとなるのです。
次に変化量ですが、平衡に達した後の水素イオン濃度がxとなるので、水素イオンの変化量は+xです。そして化学反応式の係数を見ると、1:1:1なので酢酸の変化量は-xで、酢酸イオンの変化量は+xとなります。
よって平衡に達した後は、酢酸のモル濃度はC-xとなり、酢酸イオンのモル濃度はC+xとなり、水素イオン濃度はxとなります。やはり酢酸イオンの部分が通常の電離平衡とは違う形になるので注意しましょう。
これで平衡に達した後のそれぞれのモル濃度が分かったので、酢酸の電離定数Ka=[CH3COO-][H+]/[CH3COOH]にそれぞれのモル濃度を代入します。ここで酢酸は弱酸なので電離度がとても小さく、xの量はCの量に比べて非常に小さいので、C-x≒C、C+x≒Cとして近似することができます。このように近似ができるのが電離平衡の特殊な計算方法でした。したがって、この式はCで約分できるので、結局、水素イオン濃度はx=Ka=1.8×10-5mol/Lとなります。
今回のように酢酸と酢酸ナトリウムを同じ量混ぜて緩衝液を作ることは多いので、酢酸と酢酸ナトリウムを同じ量混ぜて作った緩衝液の水素イオン濃度は電離定数と等しくなるということは知っておくと便利です。
それでは、pHを求めていきます。
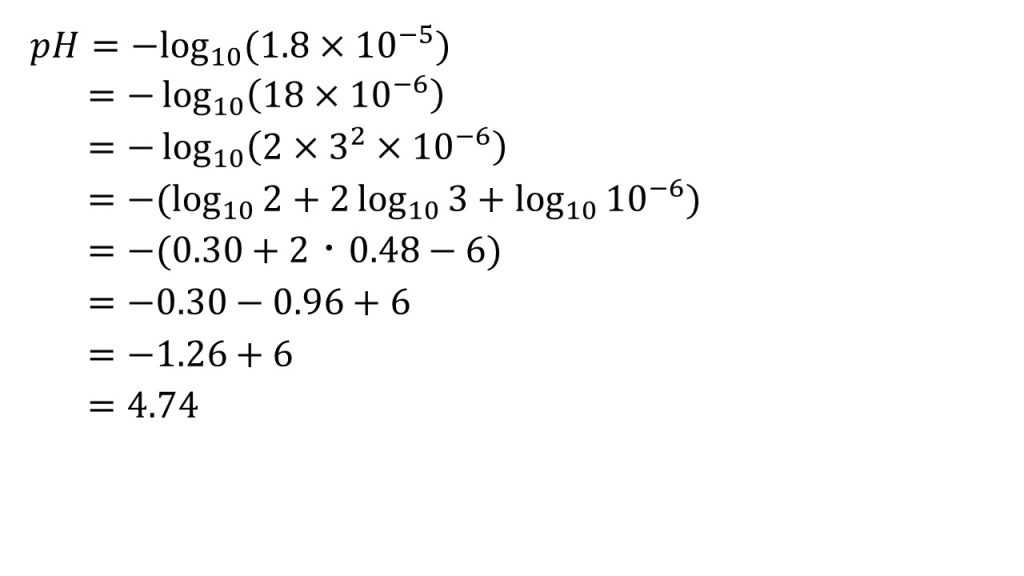
pH=-log10[H+]なので、先ほど求めた水素イオン濃度の1.8×10-5を代入します。そしてここからは対数の計算となります。ポイントは、log102とlog103を作ることです。まずは、1.8×10ー5を18×10-6とし、18は2×32とします。そして、真数のかけ算は対数の足し算となり2乗は前に出るので、-log10(2×32×10-2)=-(log102+2log103+log1010-6)となります。log102=0.30、log103=0.48として計算すると、答えはpH=4.74となります。
これで酸や塩基を入れる前の緩衝液のpHが出ました。
問題②(緩衝液に酸を加えたときのpH)
それでは次に酸を入れたときにこのpHがどのように変化するかを計算していきます。それでは問題を確認していきます。
酢酸ナトリウムと酢酸を5.0×10-2molずつ溶かした水溶液の1.0Lに、5.0mol/Lの塩酸2.0mLを加えたときのpHを求めてみましょう。ただし酢酸の電離定数Ka=1.8×10-5mol/Lとし、求めるpHは小数第2位までで答えます。さらにlog102=0.30、log103=0.48とし、今回の水溶液の体積は常に1.0Lで変わらないものとする。
塩酸を加える前の水溶液は先ほどの問題の緩衝液で、このpHは4.74でした。この緩衝液に塩酸という強酸を加えたときにpHがどのように変化するか計算していきましょう。
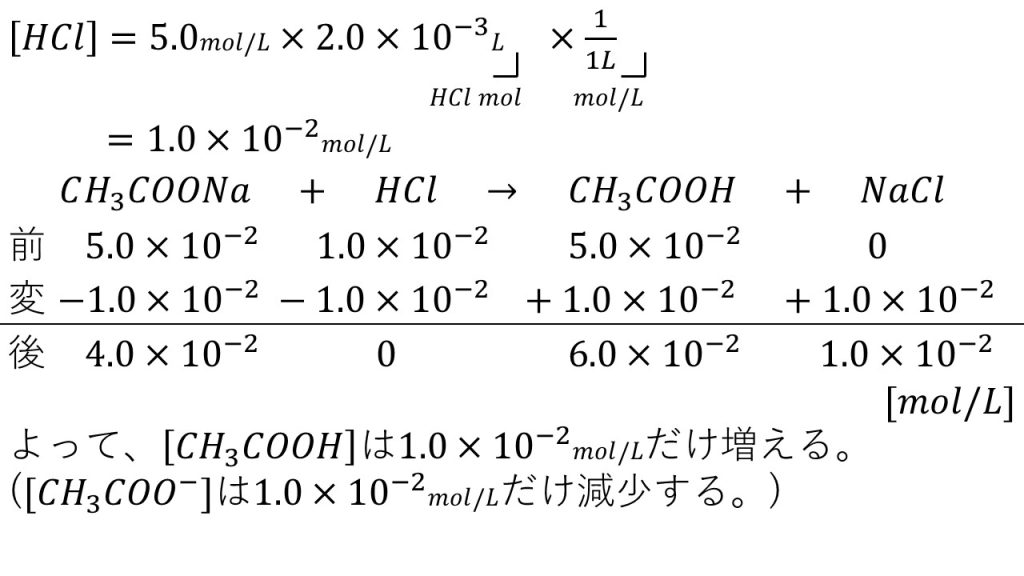
加えた後の塩酸のモル濃度を求める
まずは水溶液に加えた後の塩酸のモル濃度を求めてみます。加える前のモル濃度に加える前の体積をかけることで、溶質であるHClの物質量となります。そして、それを加えた後の体積で割ることで、加えた後のモル濃度となり、計算すると、[HCl]=1.0×10-2mol/Lとなります。今回は水溶液の体積は変わらないとしたので、塩酸を加えた後の水溶液の体積も1Lとして計算できます。
そして塩酸のモル濃度がでたところで、先ほど解説した緩衝液の計算方針にしたがって反応を順番に処理していきます。
酢酸の電離を考えずに、弱酸遊離だけを考える(1段階目)
まずは酢酸の電離を考えずに、酢酸ナトリウムと塩酸によって酢酸が生じる弱酸遊離(CH3COONa+HCl → CH3COOH+NaCl)から考えていきます。
反応前のモル濃度ですが、酢酸ナトリウムのモル濃度は5.0×10-2で、塩酸のモル濃度は先ほど求めた1.0×10-2です。そして反応前の酢酸のモル濃度は5.0×10-2で、塩化ナトリウムは反応前なので0です。
次に変化量ですが、化学反応式の係数の比は1:1:1:1で、塩酸は酢酸ナトリウムよりも量が少ないので、塩酸が無くなるまで反応が進行します。つまり塩酸の変化量は-1.0×10-2となり、酢酸ナトリウムの変化量も-1.0×10-2となります。そして、酢酸と塩化ナトリウムの変化量はともに+1.0×10-2となります。
したがって、反応後のモル濃度は酢酸ナトリウムが4.0×10-2で塩酸は0となり、そして酢酸のモル濃度は6.0×10-2で、塩化ナトリウムの1.0×10-2となります。
これで弱酸遊離を先に完全に起こした後で残る酢酸と酢酸イオンの量が分かりました。この反応の後に残る酢酸のモル濃度は6.0×10-2mol/Lで、酢酸イオンのモル濃度は酢酸ナトリウムのモル濃度と等しいので、4.0×10-2mol/Lとなります。あとは、これらを使って電離平衡を考えていけば緩衝液に塩酸を加えた後の水素イオン濃度を求めることができます。
ちなみに教科書や参考書では、この弱酸遊離の反応の部分を酢酸イオンと水素イオンが反応し酢酸となる反応(CH3COO-+H+→ CH3COOH)と書いてあることが多いです。これはつまり、酢酸ナトリウムが電離してできた酢酸イオンと、塩酸が電離して出てきた水素イオンが反応しているという意味です。弱酸遊離の実質的な反応は、この反応なので、CH3COONa+HCl→ CH3COOH+NaClの部分をCH3COO-+H+→ CH3COOHのような式で書くこともできます。もちろんどちらの反応で書いても、この反応の結果残る酢酸と酢酸イオンの量に変わりはありませんので、どちらでやっても構いません。
電離平衡を考える(2段階目)
それでは、2段階目の弱酸の電離平衡を考えていきます。
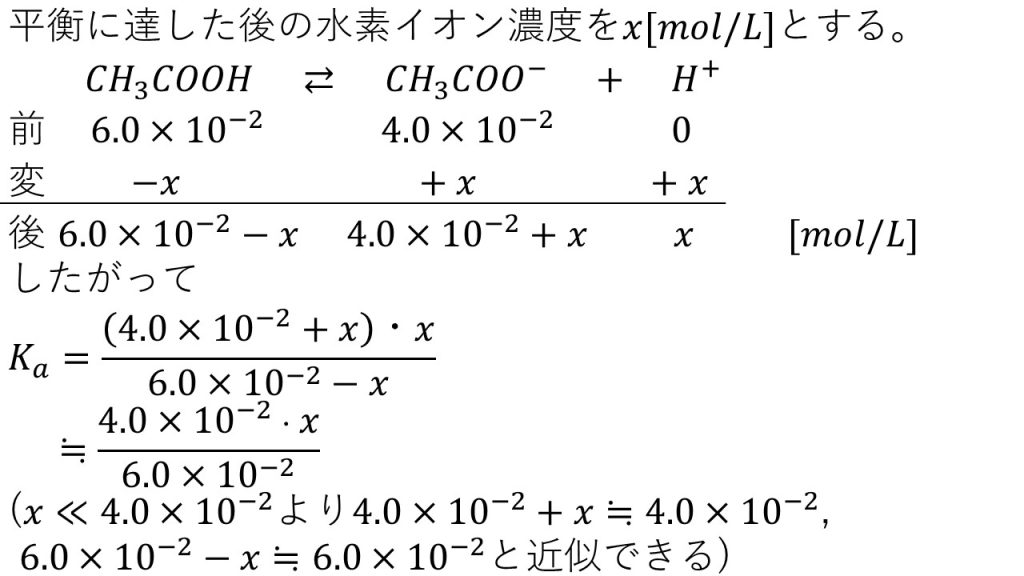
まずは平衡に達した後の水素イオン濃度をx[mol/L]とします。反応前の酢酸と酢酸イオンの量は、弱酸遊離が起きた後のモル濃度を書きます。そして変化量は平衡に達した後の水素イオン濃度がxとなるので、水素の変化量が+xとなり、酢酸の変化量は-xで、酢酸イオンの変化量は+xとなります。したがって、平衡に達した後のモル濃度は酢酸が6.0×10-2-xとなり、酢酸イオンは4.0×10-2+xとなり、水素イオンはxとなります。
これで酢酸が電離平衡に達した後のそれぞれのモル濃度が分かったので、酢酸の電離定数の式にそれぞれのモル濃度を代入します。弱酸である酢酸の電離度は非常に小さいので、問1のときと同様に引き算と足し算は近似することができます。よって、Ka≒4.0×10-2×x/6.0×10-2と近似することができます。したがって約分をして、xについて解くとx=3/2Kaとなり、Kaに1.8×10-5mol/Lを代入すると、水素イオン濃度は2.7×10-5mol/Lとなります。これで緩衝液に塩酸を加えた後の水素イオン濃度を求めることができました。
ちなみにxの値は2.7×10-5なので、4.0×10-2と比べると1/1000よりも小さいです。そのため、今回使った近似は妥当であったと言えます。
pHを求める
それでは求めた水素イオン濃度を使ってpHを求めていきます。
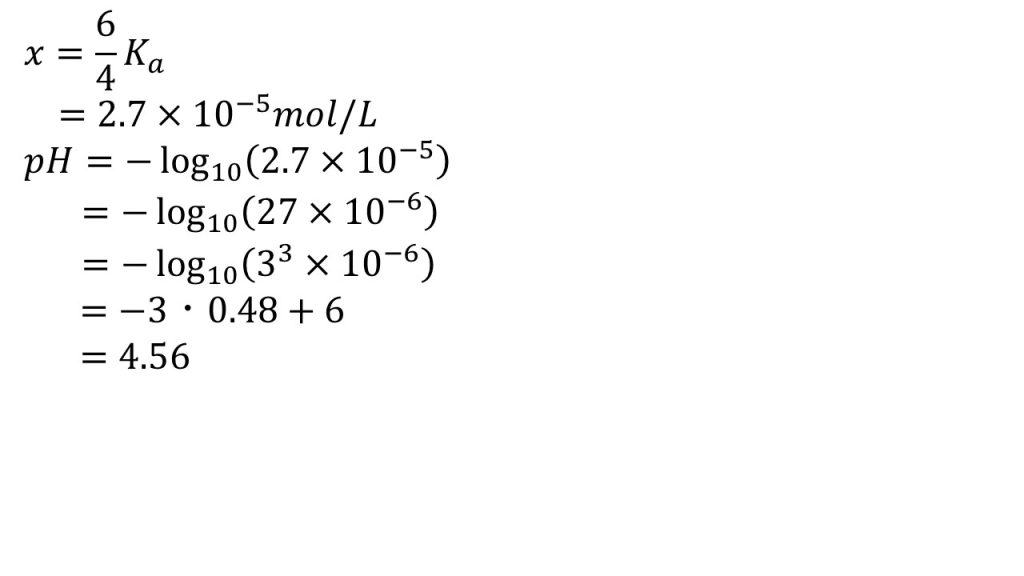
pH=-log10[H+]なので、代入すると、pH=-log10(2.7×10-5)となります。2.7×10-5を27×10-6とし、27は3の3乗なので、真数のかけ算を対数の足し算としたら、-(log1033+log1010-6)となり、log103=0.48として計算すると、pH=-(3×0.48-6)となって、答えは4.56となります。
ここで塩酸を加える前のpH(問1で求めた4.74)と比べてみると、塩酸という強酸を加えたのにも関わらずpHはあまり変化していないことが分かると思います。
いかがだったでしょうか。今回の解説で、緩衝液の計算問題は弱酸遊離や中和を先に処理して、残ったもので電離平衡を考えれば確実に解くことができるということが分かったと思います。緩衝液に酸や塩基を加えるときのように、2つの現象が同時に起きるような場合は、2つに分けて順番をつけて考えるという思考法は、緩衝液だけでなく他の理科の単元やあるいは日常生活でも役に立つ考え方です。ぜひ身につけておいてください。
(3)解説授業の内容を復習しよう
(4)電離平衡の解説一覧
①電離平衡の基本(弱酸・弱塩基の電離度とpHを求めます。近似についても解説しています)
②電離平衡で考える塩の加水分解(「塩の加水分解は存在しない」と言える理由、計算の進め方、水のイオン積についても解説しています)
③緩衝液①(緩衝液とは何か、緩衝液のイメージ、緩衝液の計算方針について解説しています)
④緩衝液②(緩衝液の計算、緩衝液に酸を加えたときのpHの計算)
(5)参考
☆化学の解説動画・授業動画一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識テスト一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学の解説・授業・知識・演習問題一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学の語呂合わせ(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
「化学計算の王道」シリーズは『思考訓練の場としての体系化学』(GHS予備校)を参考にしています。
GHS予備校についてはこちら→https://ghs-yobikou.co.jp/
思考訓練シリーズの購入はこちら→https://ghs-yobikou.shop/
