(1)解説授業動画
☆YouTubeチャンネルの登録をよろしくお願いします→大学受験の王道チャンネル
(2)解説授業の原稿
今回は中和の計算の解説をします。
中和とは何か
まずは、中和とはどのような反応なのかを確認します。
中和は酸と塩基が反応して塩と水を生成する反応のことです。
例えば、酸である塩酸と、塩基である水酸化ナトリウムが反応すると塩化ナトリウムという塩と水が生成します。
HCl + NaOH → NaCl + H2O
ただし注意しないといけないのは、中和の化学反応式はこのように書くのですが、例外を除いて、塩はほぼ100%電離します。そのため、化学反応式ではNaClと書くのですが、実際は水溶液中でNaClとしては存在しておらず、水溶液中ではナトリウムイオンと塩化物イオンがくっつくことなくバラバラに漂っているだけなのです。
したがって、中和反応において実際に起きているのは、酸から出た水素イオンと塩基から出た水酸化物イオンがくっついて水を生成する反応なのです。
H+ + OH- → H2O
中和の計算方針
これが実質的な反応なので、計算をするときは、
水素イオンの物質量=水酸化物イオンの物質量
で方程式を立てて解くことになります。
つまり中和が完了するときは、酸から出た水素イオンと塩基から出た水酸化物イオンが全て水になったときなので、この方程式が成り立ちます。
問題①:中和の計算の基本
それでは実際にこの解法で問題を解いてみます。なお、今回扱う問題は、全て有効数字2桁で答えます。
水酸化ナトリウム4.0gを水に溶かします。そして、その水酸化ナトリウム水溶液を中和するには0.20 mol/Lの硫酸が何mL必要か求めてみます。ただし水酸化ナトリウムの式量は 40とします。
まずは求める硫酸の体積をV[mL]として、先ほど確認した、「酸から出た水素イオンの物質量=塩基から出た水酸化物イオンの物質量」の方程式を作っていきます。
電離の反応式を確認
方程式を作る前に、今回の酸と塩基の電離の式を確認します。
硫酸:H2SO4 → 2H+ + SO42-
水酸化ナトリウム:NaOH → Na+ + OH-
慣れてきたらこの電離の式は省略しても構いません。
方程式を立てる
それでは方程式の左辺を作っていきます。
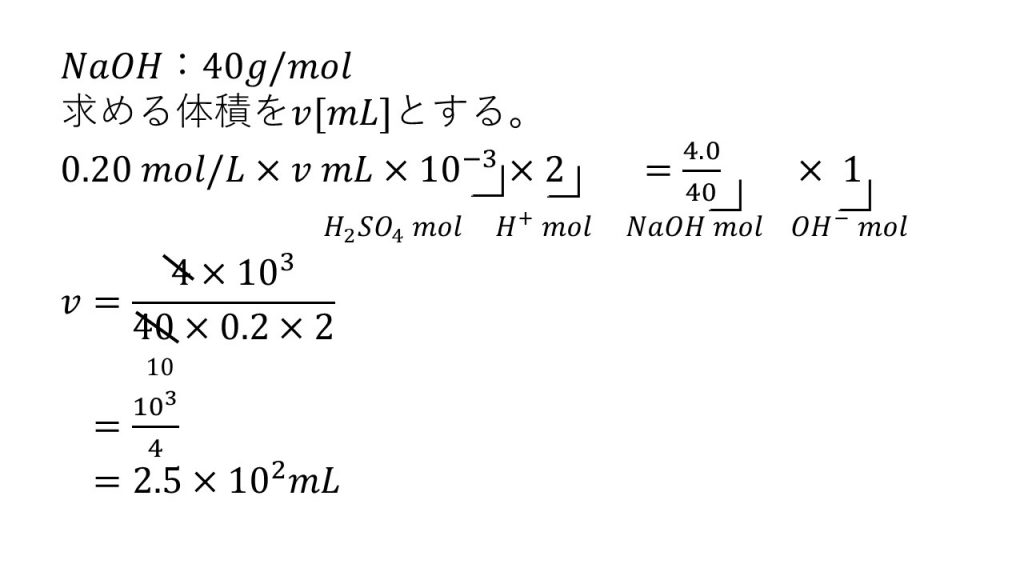
左辺は硫酸から電離した水素イオンの物質量です。
硫酸のモル濃度に硫酸のリットルをかけることで硫酸の物質量となります。そして、それに2をかけることで、H+の物質量となります。なぜ×2なのかというと、この硫酸の電離の式から硫酸1molに対して水素イオンが2mol発生するということが分かるからです。
このように中和の方程式を作るときは、そこまでで何が出ているのかをメモしながら式を作るようにしましょう。
それでは右辺です。右辺は水酸化ナトリウムから電離する水酸化物イオンの物質量です。
水酸化ナトリウムの質量を水酸化ナトリウムのモル質量で割ることで、水酸化ナトリウムの物質量とします。そして、それに×1をすることで、水酸化物イオンの物質量となります。なぜ×1なのかは、水酸化ナトリウムの電離の式から水酸化ナトリウム1molに対して発生する水酸化物イオンは1molなので、×1となります。
よくこの×1を書かない人がいるのですが、この×1がなければ式の意味が変わってしまうので必ず書くようにしましょう。
これで「酸から出た水素イオンの物質量=塩基から出た水酸化物イオンの物質量」の方程式ができたので、あとはこれを解くことで答えが出ます。
工夫しながら方程式を解く
こういった方程式を解くときは、まず左辺を求める文字だけにして、残りをすべて右辺に集めます。
その際、分母の10-3は、分子に103として書くようにすると計算がしやすくなります。
あとはできるだけ約分をしていき、式を簡単にして有効数字2桁で答えると、答えは2.5×102mLとなります。
このように中和の計算をするときは、左辺に酸から出た水素イオンの物質量を書き、右辺に塩基から出た水酸化物イオンの物質量を書いて、方程式を作るようにすれば、基本的にどのような問題でも解くことができるようになります。
問題②:逆滴定(塩基が2つ)
次に、この問題を解いてみます。
1.0mol/Lの硫酸20mLにある量のアンモニアを吸収させた。ただ、アンモニアを吸収させた後も、この水溶液はまだ酸性だったので、0.50mol/Lの水酸化ナトリウム水溶液36mLを入れることで、中和が完了した。では最初に吸収させたアンモニアの質量は何gか求めてみましょう。ただし、アンモニアの分子量は17とします。
アンモニアの電離の反応式
硫酸の電離の式と水酸化ナトリウムの電離の式は先ほど書いたので、今回はアンモニアの電離の式を書きます。
NH3 + H2O ⇄ NH4+ + OH-
アンモニアの電離の式を書くときに注意するのが、アンモニア分子自体は水酸化物イオンを持っておらず、水と反応することで水酸化物イオンを出すと言うことです。
またアンモニアは弱塩基なので実際は平衡反応となっています。しかし弱塩基であろうが弱酸であろうが、中和をするときは、水酸化物イオンや水素イオンが完全になくなるまで反応が進行するので、中和の計算を考える上では平衡を考える必要はありません。
方程式を立てる
それでは方程式を作って問題を解いていきます。
まずは、求めるアンモニアの質量をw[g]とおきます。

左辺は酸から出た水素イオンの物質量を書きます。今回の問題で出てくる酸は、硫酸だけなので、左辺は硫酸から出る水素イオンの物質量を書きます。
硫酸のモル濃度に硫酸の体積をかけることで硫酸の物質量とし、硫酸は2価の酸、つまり硫酸1 molに対して2 molの水素イオンを出す酸なので、×2をすることで、水素イオンの物質量となります。
そして右辺です。右辺は、塩基から出た水酸化物イオンの物質量を書くのですが、今回、塩基はアンモニアと水酸化ナトリウムの2つあるので、それぞれから出た水酸化物イオンの物質量を求めて足したものが右辺となります。
まずはアンモニアから発生する水酸化物イオンの物質量を求めてみます。
アンモニアの質量をアンモニアのモル質量で割ることで、アンモニアの物質量となります。そして、アンモニアの電離の式を見ると、アンモニア1molに対して水酸化物イオンが1 mol発生するので、アンモニアは1価の塩基であるということがわかります。そのためアンモニアの物質量に×1をすることで、水酸化物イオンの物質量となります。
そしてアンモニアを吸収させた後、水酸化ナトリウム水溶液を加えているので、水酸化ナトリウムから発生する水酸化物イオンの物質量を加えます。
水酸化ナトリウム水溶液のモル濃度に溶液の体積をかけることで、溶質である水酸化ナトリウムの物質量となり、水酸化ナトリウムは1価の塩基なので、×1とすることで水酸化物イオンの物質量となります。
この問題のように酸や塩基が 2つ以上あったとしても、左辺を酸から出る水素イオンの物質量とし、右辺を塩基から出る水酸化物イオンの物質量とすることで方程式を作ることができます。
工夫しながら方程式を解く
それでは方程式を解いていきます。
まずは求めたい文字を含む項を左辺にし、それ以外を右辺に集めます。
そして次にまだ計算をせずに、くくり出せるだけくくり出していきます。更に5でくくり出せるので、くくり出していきます。
くくり出せるだけくくり出してから、カッコの中を先に計算して両辺を17倍します。そして1.1×17を計算して、20をかけて、有効数字2桁になるように四捨五入をすれば、答えが0.37gとなります。
このように計算すれば、筆算を使わずに計算することができます。
逆滴定とは
ちなみに、この問題のような操作のことを逆滴定と言います。
アンモニアなど気体を滴定するときに使う手法です。
気体のままだと滴定しにくいので、まずは過剰な量の硫酸に吸収させて、中和しきれなかった部分を、濃度がわかっている水酸化ナトリウム水溶液で中和し、その量を測定します。
こうすることで、水酸化ナトリウム水溶液の量から逆算してアンモニアの量を求めるのが逆滴定です。
指示薬は何を使えばいいのか?
また今回の滴定ではメチルオレンジを指示薬として使います。
どの指示薬を使うかの判断は中和反応によって生成する塩によって決まります。今回は硫酸とアンモニアによって硫酸アンモニウムが、硫酸と水酸化ナトリウムによって硫酸ナトリウムが生成します。
硫酸ナトリウムは強酸と強塩基の塩なので何も起きませんが、硫酸アンモニウムは強酸と弱塩基の塩なので、塩の加水分解を起こし中和点が酸性寄りにズレるので、メチルオレンジを使います。
塩の加水分解についてはまた別の動画で詳しく解説します。
問題③:食酢の濃度
それでは最後にこのような問題を解いてみます。
市販の食酢10mLを10倍に水で希釈し、100mLとした。この希釈した水溶液10mLを、0.10mol/Lの水酸化ナトリウム水溶液で滴定したところ、7.0mLで中和した。もとの食酢のモル濃度と質量パーセント濃度を求めてみましょう。ただし酢酸の分子量は60とし、食酢の密度は1.0g/cm3とします。
この問題は市販のお酢の濃度を求める問題で、中和の計算の定番問題となっています。この問題ができるようになれば、中和の計算の基本が身に付いたと言えます。
それでは解いていきます。
酢酸の電離の反応式を確認
まず前提として、お酢は酢酸の水溶液です。そのため、まず酢酸の電離を確認します。
CH3COOH ⇄ CH3COO- + H+
酢酸はこのように電離するので1価の酸です。
方程式を立てる
それでは方程式を作るために、求める食酢のモル濃度をCとします。

そして左辺を水素イオンの物質量、右辺を水酸化物イオンの物質量とした方程式を立てます。
水で希釈したり、その希釈した水溶液の一部を取り出したりして、ややこしくなりがちですが、とにかく重要なのは水素イオンの量です。そのため水素イオンの量を丁寧に追って行けば、間違えることなく方程式を作ることができます。
もとの食酢のモル濃度に、もとの食酢の体積をかけることで、もとの食酢に含まれる酢酸の物質量が出ます。そして酢酸は1価の酸なので×1をすることで、もとの食酢に含まれる水素イオンの物質量が出ます。
このもとの食酢を10倍に水で希釈していますが、水を加えただけでは水素イオンの量に変化はありません。なぜなら、水を加えることで水素イオンが増えたり減ったりはしないからです。
しかしこの後、薄めた水溶液から10mLを取り出したときに、水素イオンの量は変化します。つまり、100mLのうちから10mLを取り出しているので、もとの水素イオンの物質量を10/100倍することで、取り出した後の水素イオンの物質量となるのです。
そしてこの取り出した水素イオンと、水酸化ナトリウム水溶液は中和しています。
右辺は水酸化ナトリウム水溶液のモル濃度に、溶液のリットルをかけることで、溶質の水酸化ナトリウムの物質量となり、×1をすることで水酸化ナトリウムから発生した水酸化物イオンの物質量となります。
これで方程式ができました。やはりポイントは水での希釈や取り出しによって水素イオンの物質量がどうなるかをしっかりと考えることです。
あとは方程式を解いていきます。まず、左辺は求めたい文字だけにして、残りを右辺に集めます。そして約分できるだけ約分をして、残ったもので計算すれば、答えは0.70mol/Lとなります。
濃度変換(モル濃度を質量パーセント濃度に変換する)
次に質量パーセント濃度を求めます。モル濃度が出たので、あとは濃度変換をするだけです。
質量パーセント濃度は、溶質の質量/溶液の質量×100となるようにします。
式は以下のようになります。

まずは分母を確認すると、食酢の密度1.0g/cm3に、食酢の体積10㎤をかけることで、溶液の質量となります。ちなみに、1mL=1cm³です。
また分子ですが、求めた食酢のモル濃度に、食酢の体積をかけることで溶質の物質量が出ます。そして、溶質は酢酸なので、酢酸のモル質量をかけることで溶質の質量となります。
これで溶質の質量/溶液の質量となったので、あとは100倍することで、質量パーセント濃度となります。約分をして計算すると、答えは4.2%となります。
今回、体積は問題に合わせて10mLとしましたが別に1Lとしても問題ありません。なぜなら濃度は体積によって変わらないからです。
もしこの濃度計算が不安な場合は、濃度計算の基本を復習するようにしてください。
いかがだったでしょうか。中和の計算は、「酸が出した水素イオンの物質量=塩基が出した水酸化物イオンの物質量」の方程式を作るという基本を守れば、確実に解くことができるということがわかったと思います。ぜひ自分でもできるように復習しておいてください。
(3)解説授業の内容を復習しよう
(4)中和の計算、pHの計算の解説
②塩の加水分解と弱酸遊離の原理(弱酸の性質によって起きる現象)
③中和の計算を極める問題(複数の反応を扱った問題の解法、弱酸(弱塩基)遊離→逆滴定)
④pHの計算(対数を使った計算、pOHとの関係、水のイオン積Kwについても解説しています)
⑤塩の水溶液の液性(硫酸水素カリウムの水溶液の液性が酸性になる理由についても解説しています)
(5)参考
☆酸と塩基、中和(化学基礎)の解説・授業・知識・演習問題一覧
☆化学の解説動画・授業動画一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識テスト一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学の解説・授業・知識・演習問題一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学の語呂合わせ(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
「化学計算の王道」シリーズは『思考訓練の場としての体系化学』(GHS予備校)を参考にしています。
GHS予備校についてはこちら→https://ghs-yobikou.co.jp/
思考訓練シリーズの購入はこちら→https://ghs-yobikou.shop/
