(1)解説授業動画
☆YouTubeチャンネルの登録をよろしくお願いします→大学受験の王道チャンネル
(2)解説授業の原稿
今回は化学平衡の基本について解説します。
そもそも化学平衡とは何か?
まずはそもそも化学平衡とはどのような状態かについて説明します。
化学平衡とは、可逆反応において正反応の速さと逆反応の速さが等しくなった状態のことを言います。
可逆反応とは?
では、可逆反応とはどのような反応なのかというと、例えば、水素とヨウ素を密閉容器の中に入れたら、水素とヨウ素は反応してヨウ化水素が生成します。
H2 + I2 → 2HI
しかし、逆にヨウ化水素を密閉容器の中に入れておくと、ヨウ化水素が分解し、水素とヨウ素が生成する反応が起きます。
2HI → H2 + I2
このように水素とヨウ素が反応してヨウ化水素が生成する反応は、左辺から右辺の反応だけでなく右辺から左辺の反応も起きます。
H2 + I2 ⇄ 2HI
このように、どちら向きの反応も起こすことができる反応のことを可逆反応と呼びます。
ちなみに左辺から右辺の反応、つまり右向きの反応のことを正反応、そして右辺から左辺の反応、つまり左向きの反応のことを逆反応と言います。そして、この正反応と逆反応の速さが等しくなった状態のことを平衡状態と呼んでいるのです。
「見かけ上」反応の侵攻が停止している
平衡状態では、正反応の速さと逆反応の速さが等しいので、見かけ上反応の進行が停止しています。この「見かけ上」ということが重要になります。
見かけ上、つまりこの反応全体を見てみると、左辺も右辺もどちらも増加も減少もしていないので、変化していないように見えるのですが、実際は正反応と逆反応がともに絶えず続いています。つまり、ヨウ化水素が生成しているのと同じ速さでヨウ化水素が分解しているので、見かけ上反応が停止しているように見えるのです。
よく平衡状態はエスカレーターで例えられます。例えば、下っているエスカレーターの上を逆走して上っている人がいたとします。その人がエスカレーターの速さと同じ速さで逆走するとエスカレーターも足も常に動いてはいるのですが、外から見た人にとってはその人は止まっているように見えます。これが化学平衡の状態です。
正反応と逆反応
また可逆反応についていくつか補足しておきます。
まずは水素とヨウ素が反応してヨウ化水素が生成する反応のことを正反応と言いましたが、下の化学反応式のようにヨウ化水素を左辺に水素とヨウ素を右辺に置いた場合は、ヨウ化水素が分解して水素とヨウ素が生成する反応のことを正反応と呼びます。
2HI ⇄ H2 + I2
つまり結局、左辺や右辺が何であろうと、左辺から右辺の右側の反応のことを正反応と呼び、右辺から左辺の左側の反応のことを逆反応と呼ぶのです。
不可逆反応について
また、下の反応のように、亜鉛に硫酸を加えて硫酸亜鉛と水素を発生させるような反応のことを不可逆反応と言います。
Zn + H2SO4 → ZnSO4 + H2
なぜ不可逆なのかというと、この反応は右辺から左辺の逆反応が基本的には起こらず、左辺から右辺の正反応が一方的に起きるからです。
しかし、このような反応でも、密閉容器の中で起こし、水素が逃げないようにすれば、実際はごくわずかですが逆反応が起きます。これは普段なら無視できるレベルの小さな反応ではありますが、しかしゼロではなく起きていることは起きているので、このように不可逆反応と呼ばれている反応も、厳密な意味では可逆反応と言えます。
化学の世界において100%一方向に起きる反応というものは存在せず、どんなに強力な反応であってもほんのわずかの逆反応は起きています。そのため実際は、この世界にある反応はすべて可逆反応ということができ、一見止まっているように見える反応もすべて平衡状態にあると捉えることができます。この点も化学平衡を学ぶ上で知っておきたいことです。
化学平衡のグラフ
それでは次に平衡に達するまでの時間と量の関係のグラフを確認してみます。平衡の問題はよくグラフの読み取りも出題されるので、ポイントを押さえてグラフを読み取れるようになっておきましょう。
縦軸:反応物の量、横軸:時間
例えば、先ほどの水素とヨウ素が反応してヨウ化水素を生成する反応における左辺の反応物の量は、時間とともに下図のように変化します。
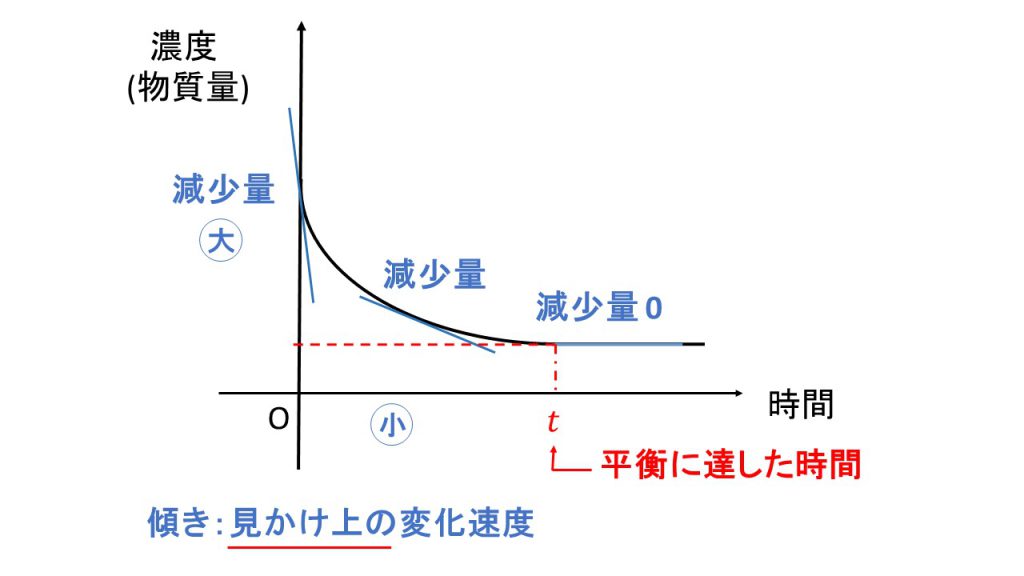
縦軸は濃度あるいは物質量のことなので、反応物があとどれくらい残っているかを表しています。反応物は時間とともに減少していき、やがて横軸と並行、つまり増加も減少もしなくなります。
縦軸:生成物の量、横軸:時間
また生成物が生成される量は時間とともに増加していき、やがて横軸と並行、つまり増加も減少もしなくなります。生成物のグラフは下図のようになります。
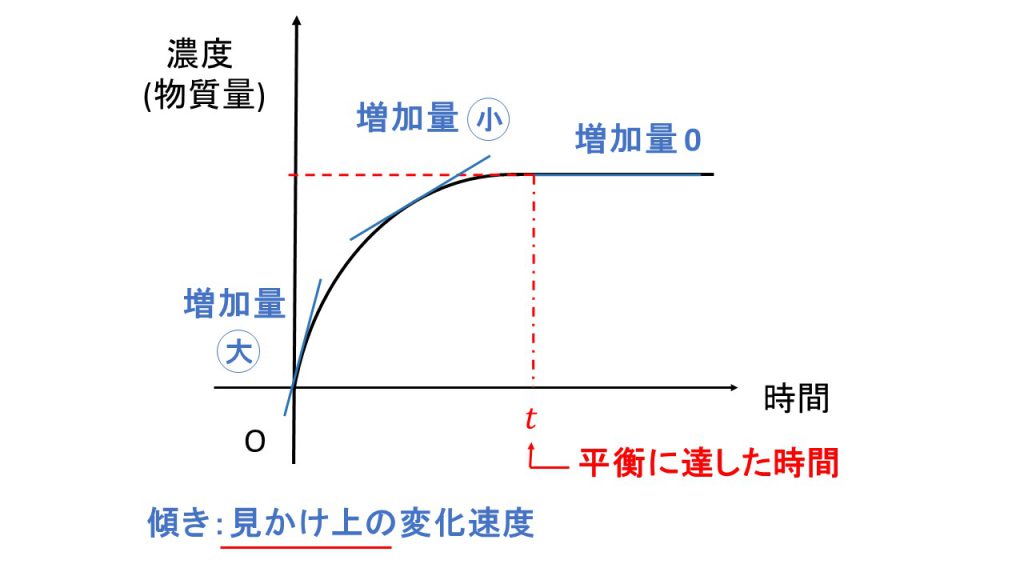
そして、この反応物と生成物がともに増加も減少もしなくなったときが、平衡に達した瞬間ということになります。
グラフの傾きが表すもの
そしてもうひとつこのグラフにおいて見るべきポイントがあります。それはグラフの傾きです。
このグラフにおける傾きは見かけ上の変化速度を表しています。
例えば、反応物であれば反応のし始めは傾きが急になっており、それはつまり見かけ上の減少量が大きくなっています。
なぜそうなるのかというと、反応のし始めはヨウ化水素はまだほとんどなく、周りに水素とヨウ素がたくさんある状態です。そのため、水素とヨウ素がくっついてヨウ化水素となる反応がたくさん起きるので、反応物である水素とヨウ素は急激に減ることになります。やがて傾きが緩やかになります。つまり見かけ上の減少量が小さくなっていくのですが、これは反応物である水素とヨウ素が反応によって消費されてどんどん少なくなっているということに加えて、生成したヨウ化水素による逆反応も起きるので、見かけ上の減少量が小さくなるからです。そして、やがて平衡に達したときに見かけ上の減少量はゼロになります。平衡状態に達しているので、見かけ上は増加も減少もしなくなります。
同様に生成物の傾きを確認してみると、生成し始めたときは水素とヨウ素がくっつく反応がたくさん起こるので増加量は大きくなり、傾きも大きくなります。そして、時間が経つと反応する水素とヨウ素の量が減り、かつヨウ化水素が分解する反応も起こるので、見かけ上のヨウ化水素の増加量は小さくなり、傾きも小さくなります。そして、やがて平衡に達すると増加も減少もしなくなり、見かけ上の増加量はゼロとなります。
平衡に達したとき、ともに増加量も減少量もゼロとなるわけですが、これはどちらも「見かけ上の」増加量と減少量がゼロになっているということに注意してください。先ほども確認した通り、平衡に達しても反応自体は起きています。そのため、水素とヨウ素の減少もヨウ化水素の増加もどちらも起きているのですが、反応物の減少速度と生成物の増加速度が等しくなるので見かけ上変化しないことになるのです。
グラフに関して2点ほど補足します。
縦軸:(実際の)反応速度、横軸:時間
まずは実際の反応速度のグラフがどのようになるかを確認します。縦軸を実際の反応速度にした場合、下図のようなグラフになります。
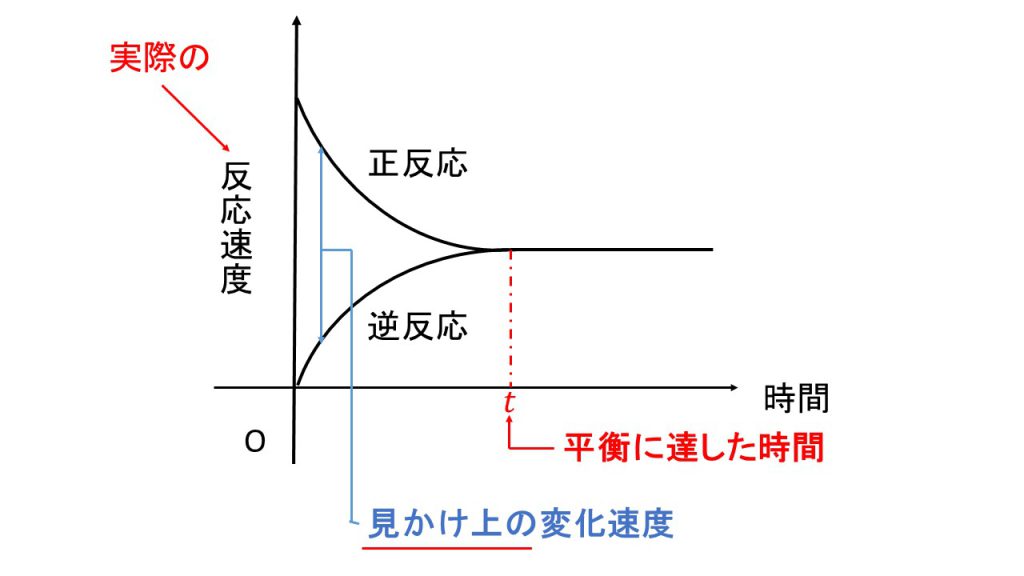
正反応は反応物が少なくなっていくので徐々に反応速度が小さくなっていきます。それに対して、逆反応は生成物の量が増えていくので徐々に反応速度が大きくなっていきます。そして、やがて反応速度が一致したとき、それが平衡に達した瞬間となります。
ただし注意したいのは、縦軸は見かけ上の反応速度ではなく実際の反応速度なので、たとえ平衡に達しても、実際は正反応も逆反応も起きているので、反応速度がゼロになることはありません。
では、このグラフにおいてどこで見かけ上の変化量を表しているかというと、この正反応の速度と逆反応の速度の差が見かけ上の変化量を表しています。
つまり反応のし始めは変化量が大きく、時間が経つにつれて変化量が小さくなり、やがてその変化量がゼロとなります。そして、その変化量がゼロになったときが平衡に達した瞬間です。
反応速度のグラフはこのように読み取りましょう。
触媒を加えると
それではもう1点確認したいことは、触媒を加えたらグラフがどのように変化するか、ということです。例えば生成物の量のグラフは下図のように変化します。
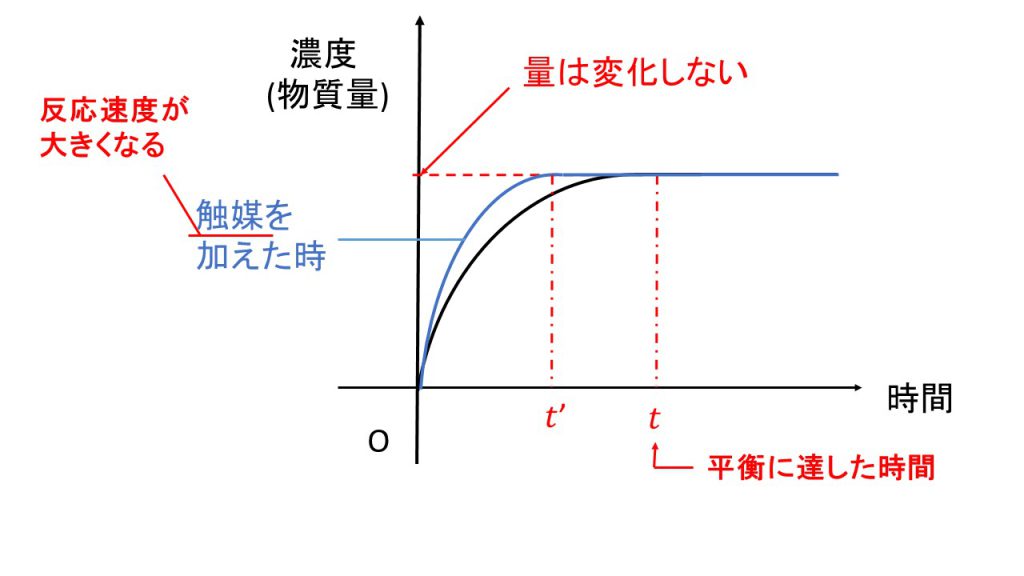
触媒とは反応速度が大きくなるものなので、触媒を加えると平衡に達するまでの時間が短くなります。
ただし注意したいのが、平衡に達したときの濃度や物質量は変化しないということです。触媒を加えるとあくまで反応速度だけが大きくなるので、生成する量は変わらないまま平衡に達するまでの時間が短くなるのです。
これで化学平衡のグラフの読み取りはできるようになったと思います。
化学平衡の法則(質量作用の法則)
それでは最後に化学平衡の法則、あるいは質量作用の法則について解説します。
平衡定数の定義
この法則を理解するために、まず平衡定数の定義を確認します。
例えば、次のような可逆反応が平衡状態に達しているとします。
aA + bB ⇄ cC + dD
このときの平衡定数をKとしたとき、Kは次のように定義されています。
K = [C]c[D]d / [A]a[B]b
これが平衡定数の定義です。例えば、先ほどの水素とヨウ素からヨウ化水素が生成するこの反応においての平衡定数は、
H2 + I2 ⇄ 2HI
K = [HI]2 / [H2][I2]
となります。[ ]はモル濃度を表しているということは必ず知っておきましょう。
平衡定数のポイントは、分子は左辺で分母は右辺ということです。そして、係数が次数となります。これらに関しては定義で決まっているので、必ずそのようにしましょう。
化学平衡の法則とは何か?
そして、平衡定数に関して最も重要なことは、「温度が一定のとき、つまり温度を変えない限り平衡定数は一定となる」ということです。これが「化学平衡の法則」です。昔はこの法則のことを「質量作用の法則」と呼んでいましたが、今は「化学平衡の法則」と呼ぶのが普通です。
平衡定数は温度以外の条件、例えば、濃度や圧力や体積などを変えても変わることはありません。
また、触媒を加えたとしても変わることはありません。触媒は反応速度が大きくなるのですが、正反応と逆反応がともに同じ割合で反応速度が大きくなるので、触媒を加えても平衡定数は変わることはありません。
例えば、この反応において平衡定数が5となるように設定したとします。この状態から温度を変えずにヨウ化水素の量を増やしてみます。するとどうなるでしょうか。ヨウ化水素の量を増やした場合、左向きの反応が起きます。その左向きの反応がどれだけ起きるのかというと、この平衡定数が5となるようにヨウ化水素の量が減り、水素とヨウ素の量が増えます。
このように、変化を加えたとしても必ず平衡定数が一定となるように反応が起き、分母と分子の量の調整が行われるのです。この法則のことを化学平衡の法則と言います。
ただし注意点があり、この法則が成り立つのは温度一定のときだけなので、温度を変えてしまうと平衡定数も変わってしまい、この法則が成り立たなくなってしまうので注意してください。
いかがだったでしょうか。以上が化学平衡の基本となります。今回解説したことを理解したうえで平衡移動や平衡の計算問題に取り組むようにしてください。
(3)解説授業の内容を復習しよう
(4)気体の平衡の解説一覧
①化学平衡の基本(化学平衡とは何か、可逆反応・不可逆反応、グラフの読み取り、平衡定数の定義、化学平衡の法則・質量作用の法則)
②平衡移動(ルシャトリエの原理)の解説(アルゴンを加える問題、二酸化窒素と四酸化二窒素の平衡の色の変化についても解説しています)
③気体の平衡の計算(化学平衡の法則(平衡定数=一定)から方程式を立てる、平衡定数の求め方についても解説しています)
④圧平衡定数の導出(濃度平衡定数・圧平衡定数とは何か、平衡定数の単位についても解説しています)
⑤圧平衡定数の計算の解説(気体の平衡を考えるために必要なものについても解説しています)
⑥ハーバー・ボッシュ法の解説(なぜ高温高圧で行うのか、なぜ人類にとって重要なのか)
(5)参考
☆化学の解説動画・授業動画一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識テスト一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学の解説・授業・知識・演習問題一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
