(1)解説授業動画
☆YouTubeチャンネルの登録をよろしくお願いします→大学受験の王道チャンネル
(2)解説授業の原稿
今回はpHの計算について解説します。
pHとは何か
まずはそもそもpHとは何かについて確認します。
pHとは簡単にいうと、水素イオン濃度を
[H+]=1.0×10-〇
の形にしたときの指数のマイナスを除いた部分(〇の部分)のことです。
ちなみに、[H+]は「水素イオン濃度」と読みます。このかっこ[]は、「モル濃度」のことなので、水素イオン濃度とは「水素イオンのモル濃度」という意味です。
つまり、水素イオン濃度が[H+]=1.0×10-2になればpHは2であり、水素イオン濃度が[H+]=1.0×10-12になればpHは12ということになります。
ただ、この理解の仕方では計算がしにくいので、数式によるpHの定義も知っておきましょう。pHは
pH=-log10[H+]
といったように対数を使って表すことができます。このときマイナスをつけるのを忘れないようにしましょう。
pHの計算をするときは、この式を使うので理系の方は必ずこの式を覚えるようにしましょう。
pHの値と液性
ちなみにpH=7のとき、その水溶液は中性となり、それよりもpHが大きいときは塩基性、pHが7よりも小さいときは酸性となります。
pHが大きくなるということは、最初の式の〇の数字が大きくなるということなので、水素イオン濃度は小さくなります。そのためpHが大きくなるにつれて酸性が弱まり塩基性が強くなっていきます。
また、pHが小さくなるということは、〇の数字が小さくなるということなので水素イオン濃度は大きくなります。よってpHが小さくなるということは塩基性が弱くなり、酸性が強くなるということを意味します。
pHとOHの関係
さらにpHに関して知っておきたいのは、pHとpOHの関係です。
pOHとは
pOH=-log10[OH-]
で表されるもので、25℃のときは
pH+pOH=14
の関係が成り立ちます。なぜpHとpOHを足したら14になるかというと、25℃のときは
[H+] [OH-]=1.0×10-14
になるからです。
例えば水素イオン濃度が1.0×10-2であれば、この式に代入すると水酸化物イオンのモル濃度が1.0×10-12となります。このときpHは2で、pOHは12なので足したら14となります。
このように25℃のときはpHとpOHを足したら14となります。
ただしこの式が成り立つのは25℃のときだけなので、25℃でないときは14にならないことに注意してください。
そこで、pH+pOH=14の式を一般的に書くと、
pH+pOH=pKw
となります。Kwとは「水のイオン積」のことで、水のイオン積とは水溶液中の水素イオン濃度と水酸化物イオン濃度をかけたもののことです。
Kw=[H+] [OH-]
ちなみに、pHが7で中性になるのは、これも25℃のときです。pHが7ということはpOHも7なので、ちょうど水素イオンの量と水酸化物イオンの量が等しくなっているため、pH=7が中性となるのです。そのため温度によっては、ちょうど7が中性にならないときもあるので注意してください。
強酸のpHを求める
それではこれらを踏まえて、pHの計算をしていきます。なお今回の問題はすべて有効数字は3桁で答えます。また水溶液の温度は25℃としlog102=0.301, log103=0.277, log101.3=0.114とします。
それではまず酸のpHを求めていきます。
①0.100mol/Lの硫酸のpHを求めましょう。
基本的には定義の式を使って計算していくので、まずは水素イオン濃度を求めていきます。硫酸は
H2SO4 → 2H+ + SO42-
このように電離し、硫酸1molに対して水素イオンが2mol生成します。つまり硫酸は2価の酸なので溶液のモル濃度に×2をすることで水素イオンのモル濃度となります。よって、この水溶液の水素イオン濃度は0.200mol/Lとなります。
水素イオン濃度が出たので、あとはpHの定義の式に代入していきます。pH=-log10[H+]なので、水素イオン濃度である0.2を代入して計算をしていきます。
ここから先は数学Ⅱで学習する対数の公式を使って計算していきます。まずは0.2を2×10-1とし、対数の真数の掛け算は足し算にすることができます。そしてlog102=0.301であり、log1010-1=-1となるので、あとはそれを計算すると答えが0.699となります。酸のpHの計算はこのような流れになります。
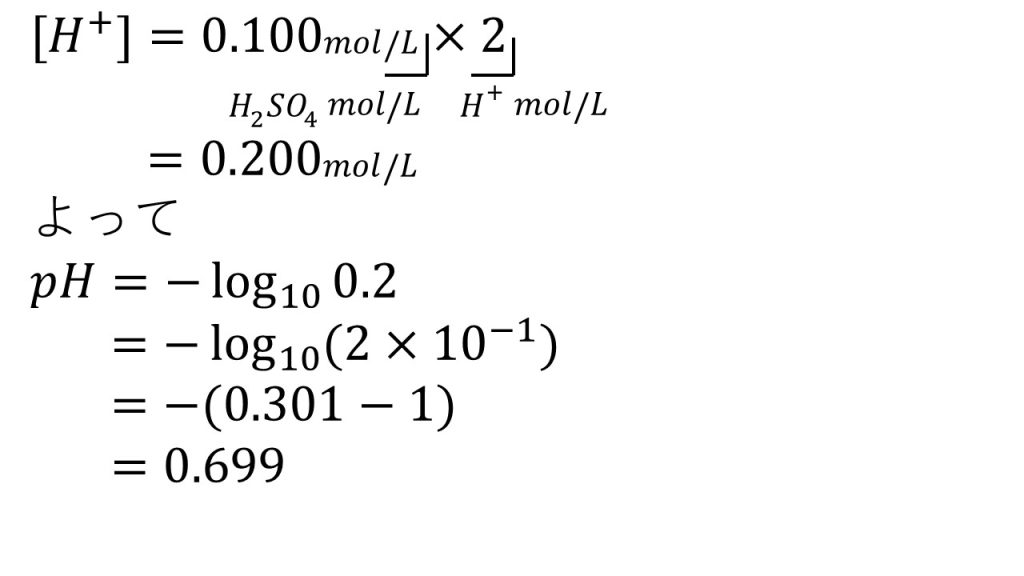
弱酸のpHを求める
それでは次に酢酸のpHの計算をしていきます。
②0.100mol/Lの酢酸水溶液(ただし電離度は0.01)のpHを求めましょう。
酢酸は
CH3COOH ⇄ CH3COO- + H+
このように電離をし、1価の酸なのですが、弱酸なのですべて電離しません。
今回は電離度が0.01なので、パーセントでいえば1%だけ電離をする、つまり酢酸が100個あれば1個だけ酢酸イオンと水素イオンに電離するということになります。
そのため、溶液の濃度に価数をかけて、それに電離度をかけることで水素イオンのモル濃度となります。これを計算すると1.0×10-3mol/Lとなります。
今回のように1.0×10-〇の形になった場合は、指数のマイナスを除いた部分を読みとってそれをpHとして答えます。よって答えはpH=3となります。
このように弱酸の場合は電離度をかけるのを忘れないようにしましょう。
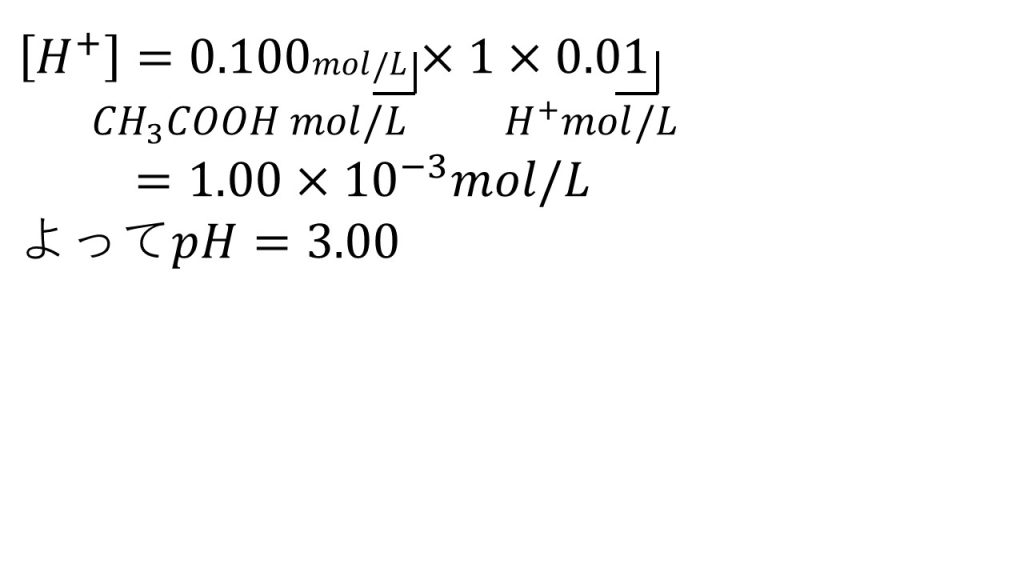
強塩基のpHを求める
それでは次は塩基のpHを求めてみます。
③0.0100mol/Lの水酸化バリウム水溶液のpHを求めましょう。
塩基のpHを求めるときも先ほどと同様に、水素イオン濃度を求めてからpHを求めるというやり方もありますが、塩基の場合は水酸化物イオン濃度を求めてからpOHを求めて、そこからpHを求めるというやり方の方が計算が楽なことが多いので、今回はそのやり方をご紹介します。
まずは水酸化物イオンのモル濃度を求めていきます。
水酸化バリウムは強塩基で
Ba(OH)2 → Ba2+ + 2OH–
このように電離をします。つまり水酸化バリウムの価数は2価なので、溶液のモル濃度に価数の2をかけることで水酸化物イオンのモル濃度となります。今回水酸化物イオンのモル濃度は2.0×10-2mol/Lとなります。
これで水酸化物イオンのモル濃度が求められたのでpOHの定義の式に代入していきます。するとpOH=-log10(2.0×10-2)となり、真数の掛け算は足し算にすることができ、log102=0.301であり、log1010-2=-2となります。
ここで1つポイントがあります。それはpOHの足し算や引き算の計算はしないで取っておくということです。
この段階までpOHの計算を進めたら、次はpH+pOH=14の式にこの式を代入します。すると、pH=14-pOHなのでpH=14+(0.301-2)となり、計算して12.301となり、有効数字が3桁となるように四捨五入して、答えは12.3となります。
このようにpH=14-pOHの計算を楽にするためにpOHの計算をこの段階で止めておいたのです。
これが塩基のpHの求め方の流れとなります。
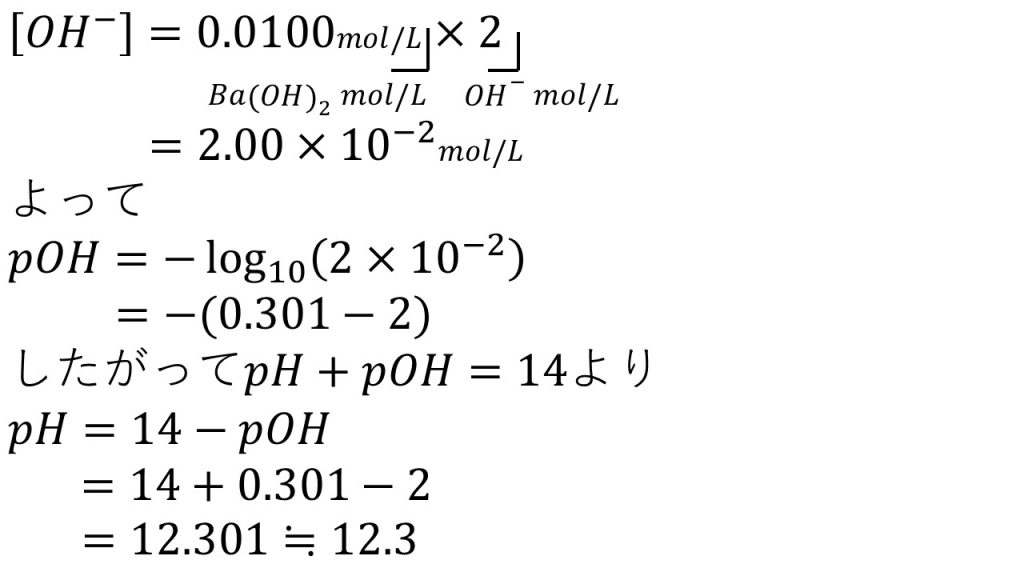
弱塩基のpHを求める
最後に弱塩基であるアンモニア水のpHを求めてみます。
④0.100mol/Lのアンモニア水(ただし電離度は0.013)のpHを求めましょう。
アンモニアは
NH3 + H2O ⇄ NH4+ + OH-
このように電離をし、1価の塩基ですが、弱塩基なので全てのアンモニアが電離をするわけではありません。
そのため、溶液のモル濃度に価数をかけて電離度の0.013をかけることで水酸化物イオンのモル濃度となります。計算すると1.0×10-3mol/Lとなります。
あとは先ほどと同じ流れでpHを求めていきます。まずはpOHの定義の式に水酸化物イオンのモル濃度を代入し、真数の掛け算を足し算にします。そして、log101.3=0.114となり、log1010-3=-3となります。
やはりpOHの計算はこの段階で止めておいて、pH+pOH=14よりpH=14-pOHなので、この式を代入し計算をすると11.114となり、有効数字3桁となるように四捨五入をして、答えは11.1となります。
いかがだったでしょうか。酸と塩基のpHの求め方あるいは弱酸と弱塩基のpHの求め方が理解できたでしょうか。数学Ⅱの対数の計算の練習にもなるのでぜひ復習しておいてください。
(3)解説授業の内容を復習しよう
(4)中和と塩(理論化学)の解説一覧
②塩の加水分解と弱酸遊離の原理(弱酸の性質によって起きる現象)
③中和の計算を極める問題(複数の反応を扱った問題の解法、弱酸(弱塩基)遊離→逆滴定)
④pHの計算(対数を使った計算、pOHとの関係、水のイオン積Kwについても解説しています)
⑤塩の水溶液の液性(硫酸水素カリウムの水溶液の液性が酸性になる理由についても解説しています)
(5)参考
☆化学の解説動画・授業動画一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識テスト一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学の解説・授業・知識・演習問題一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学の語呂合わせ(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
「化学計算の王道」シリーズは『思考訓練の場としての体系化学』(GHS予備校)を参考にしています。
GHS予備校についてはこちら→https://ghs-yobikou.co.jp/
思考訓練シリーズの購入はこちら→https://ghs-yobikou.shop/
