(1)解説授業動画
☆YouTubeチャンネルの登録をよろしくお願いします→大学受験の王道チャンネル
(2)解説授業の原稿
今回は電離平衡の基本について解説します。
電離平衡は、化学平衡の一種なので基本的な考え方は化学平衡と同じです。ただし電離平衡が対象としているものは弱酸と弱塩基で、これらの性質によって気体の平衡とは少し違った考え方をする部分もあります。今回は特にその点に注意しながら解説していきます。
弱酸・弱塩基の性質
まずは弱酸と弱塩基の性質を確認します。
弱酸の代表例は酢酸で、弱塩基の代表例はアンモニアですが、このような弱酸と弱塩基は電離度が1よりも小さいです。ちなみに強酸と強塩基は電離度がほぼ1の酸と塩基のことです。
電離平衡で扱う弱酸と弱塩基は、0.02や0.01といった電離度が1よりもかなり小さい酸や塩基を扱います。そのため、酢酸は
CH3COOH ⇆ CH3COO-+H+
のように電離しますが、実際に酢酸イオンと水素イオンに電離している酢酸はほんの少ししかないということが、電離平衡を考える上で重要になってきます。
ここでポイントとなるのが電離度が1よりも小さいので「弱」酸、「弱」塩基とよばれていますが、それは別の視点で見てみると、元に戻ろうとする力が強い、あるいは水素イオンや水酸化物イオンとの結びつきが強いと考えることもできます。
つまり酢酸がほんの少ししか電離しないということは、酢酸は水素イオンとの結びつきが強く、水素イオンを離したがらないという性質を持っていると考えられます。弱酸や弱塩基は「弱いけど実は強い」という視点を持っておくと、電離平衡が理解しやすくなります。
電離平衡のイメージ
それでは弱酸と弱塩基の性質を踏まえて、電離平衡のイメージを確認します。
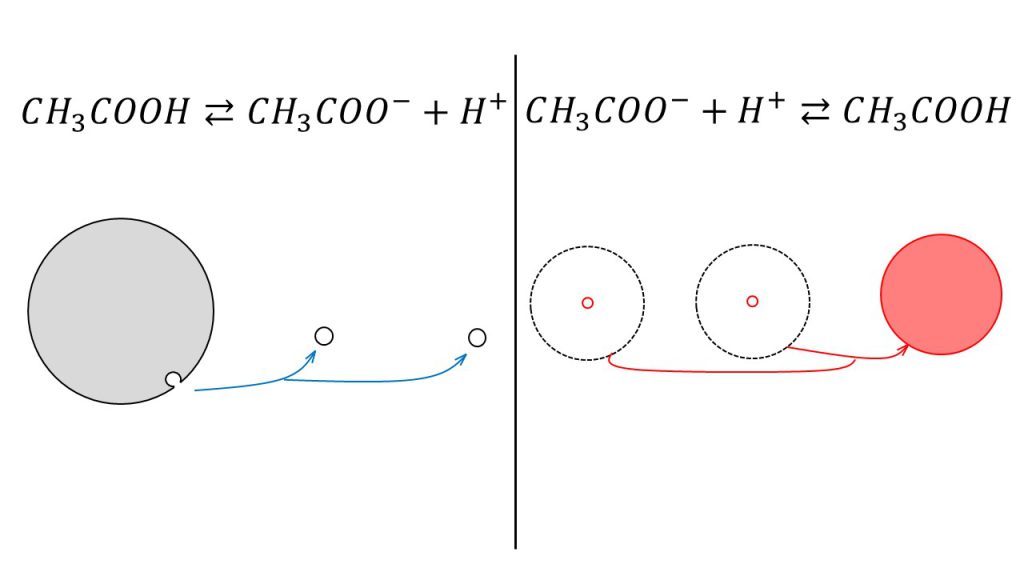
例えば、酢酸が電離するとき(CH3COOH⇆ CH3COO-+H+)は、酢酸の電離度はとても小さいので、酢酸のごく一部が酢酸イオンと水素イオンに電離します。
しかし、弱酸は「弱いけど実は強い」のでした。そのため、酢酸イオンを含む水溶液に水素イオンを加えると、酢酸イオンは強い力で水素イオンと結びつき、どちらかがほとんどなくなるまで酢酸に戻ろうとします。
このように酢酸と酢酸イオンと水素イオンが共存する水溶液では、多量の酢酸に対してほんのわずかな量の酢酸イオンと水素イオンが存在するというイメージを持っておくことが電離平衡を理解するための鍵となります。
電離平衡の計算方針
以上を踏まえて、電離平衡の計算方針を確認します。
電離平衡も化学平衡の一種なので、そのほかの平衡と同じように、温度を変えない限り平衡定数は一定となります。そのため、
Ka=[CH3COO-][H+]/[CH3COOH]
の関係を使って式を立てていくのが計算の基本的な方針となります。ちなみに電離平衡の場合、平衡定数のことを電離定数と呼びます。
弱酸の電離定数はKaと書くことが多く、例えば酢酸なら、
酢酸イオンのモル濃度×水素イオンのモル濃度/酢酸のモル濃度
となります。また弱塩基の電離定数はKbと書くことが多く、アンモニアの場合は、
Kb=[NH4+][OH-]/[NH3](アンモニイムイオンのモル濃度×水酸化物イオンのモル濃度/アンモニアのモル濃度)
となります。これらは温度を変えない限り一定なので、これによって方程式を立てることができます。
- aは”acid”(酸)、bは”base”(塩基)を表している。
ここまでは気体の平衡などと同じですが、電離平衡には1つ特殊な計算のポイントがあります。それは、「近似ができる」ということです。
なぜ近似ができるのかというと、電離平衡の対象が弱酸や弱塩基だからです。つまり、弱酸と弱塩基は電離度が1に比べて非常に小さく、例えば酢酸で言えば、酢酸の量に対して酢酸イオンと水素イオンの量が非常に小さく、それらを無いものとして計算することができるのです。
近似と聞くとややこしく感じる人もいるかもしれませんが、近似はむしろ余計な計算をしなくて良いので、計算がシンプルになります。そのため、近似ができるときはどんどん近似をしていきましょう。
それではこれらを踏まえて計算問題を解いていきます。
例題1:弱酸の電離
まずはこの問題を解いていきます。
C[mol/L]のCH3COOH水溶液がある。酢酸の電離定数をKaとするとき、電離度αと[H+]をCとKaで表せ。
①反応前・変化量・反応後の表を作る。
電離平衡も化学平衡の一種なので、気体の平衡と同様に平衡に達した後も未反応のものがあるので、反応前・変化量・反応後の表を作ります。ただし、電離平衡の問題で水溶液の体積が変わらない場合は、単位をmolではなくmol/Lで表を作ることが多いです。

まずは反応前ですが、反応前の酢酸のモル濃度はCでまだ反応していないので、酢酸イオンと水素イオンは0となります。
次に変化量ですが、電離度をαとしているので酢酸は-Cαとなります。電離度とは電離によって消費した割合ということなので、例えば電離度が0.3であれば、30%電離したということなので、変化量の大きさは元の量に0.3をかけたものになるように、電離度がαであれば、元の量にαをかけたCαになります。そして化学反応式の係数の比が1:1:1なので、変化量の大きさの比も1:1:1となり、左辺は消費したので-Cαで、右辺は生成するので+Cα、+Cαとなります。
そして反応後は反応前に変化量を足したものになるので、平衡に達した後の酢酸のモル濃度は、C(1-α)となり、酢酸イオンのモル濃度はCαとなり、水素イオンのモル濃度もCαとなります。
②電離定数を使って式を立てる。
これで平衡に達した後のそれぞれのモル濃度が出たので、平衡の計算の基本に則って、平衡定数つまり今回では電離定数で式を作っていきます。
電離平衡の分母は、弱酸や弱塩基のモル濃度([CH3COOH])で、分子には電離したもののモル濃度([CH3COOH-][H+])がきます。そのため、C(1―α)、+Cα、+Cαを代入し、Cα×Cα/ C(1―α)となります。
③近似を使って計算する
そして、ここからが気体の平衡にはない電離平衡の特殊な計算となります。
つまり、「α≪1より1-α≒1としてよい」という近似ができます。電離度αは弱酸なので1よりも非常に小さいです。そのため1-αは1とみなすことができます。もちろん厳密には1-α=1ではないのですが、例えばαが0.01のとき1-α=0.99となり、C(1-α)を0.99として計算しても、結局、有効数字の四捨五入によって、1で計算したときと計算結果が変わらなくなります。それであれば、わざわざ計算しにくいもので計算するのではなく、1としてしまって計算したほうが楽に計算ができます。
よって、Ka=[CH3COOH-][H+]/ [CH3COOH]=Cα×Cα/C(1-α)≒Cα×Cα/Cとなるので、Cを約分するとKa=C×α2となり、電離度αを求めるのでαについて解くとα=√Ka/Cとなります。
また、平衡に達した後の水素イオン濃度はCαなので、Cαのαに√Ka/Cを代入すると、水素イオン濃度[H+]=Cα=√C×Kaとなります。
いかがでしょうか。これが弱酸の電離度や水素イオン濃度の求め方の基本的な流れとなります。
Ka=[CH3COOH-][H+]/[CH3COOH]=Cα×Cα/C(1-α)までは、他の平衡の計算と同じ流れになり、Cα×Cα/C(1-α)≒Cα×Cα/ C(α<<1より1-α≒1としてよい)からが電離平衡特有の流れとなります。
なお、α=√Ka/Cや[H+]=Cα=√C×Kaはよく使うので覚えてしまっても構いません。ただし、ただ覚えるだけにならず、これまでの計算の流れで求めるものであるということは理解しておいてください。
例題2:弱塩基の電離
それでは次は、弱塩基の電離平衡を考えていきます。
2.0mol/Lのアンモニア水の電離度とpH(小数点第一位まで)を求めよ。ただし、Kb=[NH4+][OH-]/[NH3]=1.8×10-5[mol/L]とする。
電離度を求めるまでは、弱酸とのときと全く同じ流れとなります。
①反応前・変化量・反応後の表を作る。
アンモニアの電離度をαとし、反応前・変化量・反応後の表を作ります。
ただし、アンモニア自体は水酸化物イオンを持っていないので、水との反応で水酸化物イオンを電離するということは注意しておきましょう。

まず、反応前ですが、アンモニアのモル濃度は2.0mol/Lとなります。そして水は多量に存在します。なぜ多量に存在するのかというと、アンモニア水の溶媒が水だからです。つまり、溶質のアンモニアの周りにいくらでも水が存在する状況なので、このように多量に存在すると分かるように書きます。そしてアンモニウムイオンと水酸化物イオンは反応前なので0です。
次に変化量は、電離度がαなのでアンモニアはー2.0αとなり、化学反応式の係数の比が1:1:1なので、水は-2.0αで、アンモニウムイオンは+2.0αで、水酸化物イオンも+2.0αとなります。
そして平衡に達した後のモル濃度は、アンモニアは2.0(1-α)で、水は一旦飛ばして、アンモニウムイオンは2.0αで、水酸化物イオンも2.0αとなります。そして水ですが、電離度αはとても小さいのでこの-2.0αというのは、とても小さい減少量です。そのため、多量に存在する水にとっては、このほんのわずかの減少は無視できる減少なので水の量は多量のままです。この水の扱い方に関しては後でもう少し詳しく解説をします。
②電離定数を使って式を立てる。
これで平衡に達した後のアンモニアとアンモニウムイオンと水酸化物イオンのモル濃度分かったので、Kb=[NH4+][OH-]/[NH3]=1.8×10-5[mol/L]の電離定数の式に代入していきます。
③近似を使って計算する。
すると、
Kb=2.0α×2.0α/2.0(1-α)≒2.0α×2.0α/2.0
になり、αは1よりも非常に小さいので、1-αを1と近似して、2.0α×2.0α/2.0のように式が簡単になり、これが1.8×10-5[mol/L]なので、2.0×α2=1.8×10-5となります。
そしてαについて解くと、
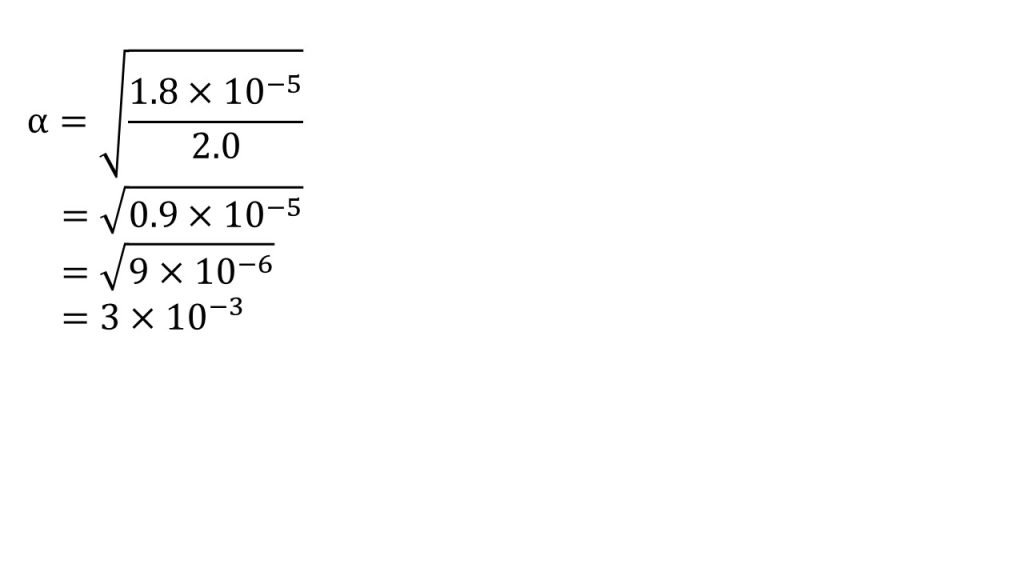
α=√0.9×10-5となり、ルートを外すために0.9を=9×10-1とすると、α=√9×10-6となり、ルートを外してα=3.0×10-3となります。これで電離度を求めることができました。
アンモニアの電離定数について
ここでアンモニアの電離定数について少し補足しておきます。
「アンモニアの電離定数の分母に水のモル濃度をかけなくていいのか」と考えた方がいるかもしれません。確かに平衡定数の定義からいえば、右辺のモル濃度/左辺のモル濃度となっていなければいけません。
そのため、この反応(NH3+H2O ⇆ NH4++OH-)の平衡定数を定義にしたがって求めると、
K=[NH4+][OH-]/[NH3][H2O]
のようになります。この式の両辺に水のモル濃度をかけてみると
K[H2O]=[NH4+][OHー]/[NH3]
のようになりますが、ここで先ほどの水は多量に存在するということを思いだしてください。つまり水溶液であれば、溶媒の水はアンモニアの量に対して非常にたくさん存在します。
それはアンモニアの電離によって減少する量など関係ないくらい多量にあります。そのため反応の前後で水の量は変わらないものと扱うことができ、それは水のモル濃度を定数扱いすることができるということを意味します。
したがって、NH3+H2O ⇆ NH4++OH-の反応の平衡定数と水のモル濃度をまとめて1つの定数と考えて、それをKbとしたものをアンモニアの電離定数としているのです。
このように平衡には関係のない量を定数と扱うことができるという考え方は知っておきましょう。
例題2の続き:pHの計算
それではpHを求めていきます。水溶液の温度は25℃であるとし、log102=0.30、log103=0.48で計算します。
今回は塩基のpHを求めるので、pOHを求めてから、pH+pOH=14の式を使ってpHを求めていきます。
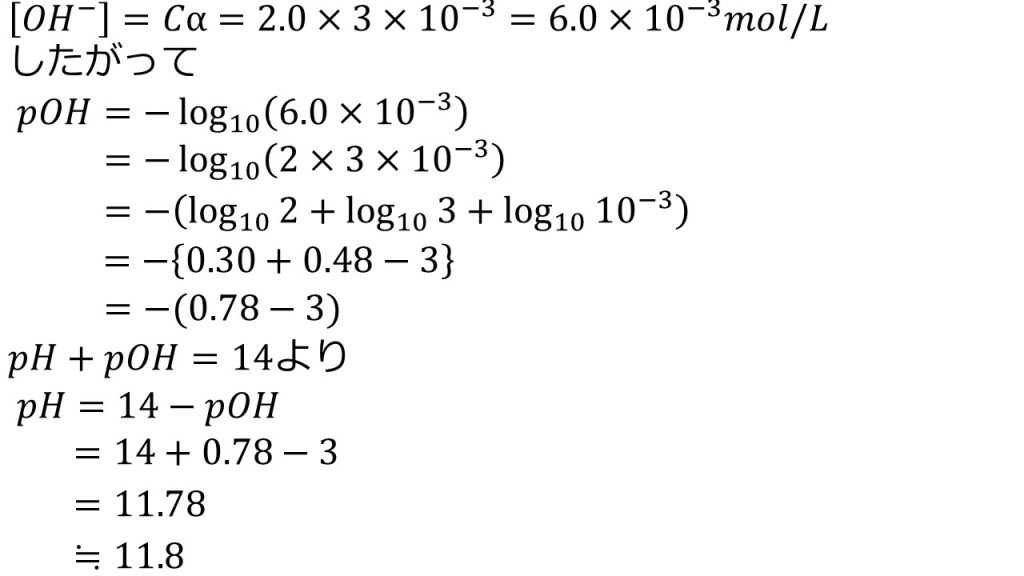
先ほどの表から平衡に達した後の水酸化物イオンのモル濃度は、[OH-]=0.2αなので、先ほど求めた電離度(α=3.0×10-3)を代入して計算すると、[OHー]=6.0×10-3mol/Lとなります。
よって、pOH=-log10[OH-]になるので6.0×10-3を代入して、pOH=-log10(6.0×10-3)となり、真数のかけ算を足し算にしてpOH=-(log102+log103+log1010-3)になります。この式変形をもう少し詳しく確認すると、pOH=-log10(6.0×10-3)の6を2×3として、真数のかけ算を足し算にしました。
そして、log102を0.30とし、log103を0.48として、log1010-3は-3なので、pOH=-(0.30+0.48-3)となって、カッコの中の簡単に計算できる部分だけ計算し、pOH=-(0.78-3)としておきます。
そして、pH+pOH=14より、pH=14-pOHとなるので、先ほど求めたpOHを代入して、pH=14+(0.78-3)を計算して、小数点第一位までになるように四捨五入をして、答えは11.8となります。
このように電離平衡の問題はpHまでを求めることが多いので、弱酸でも弱塩基でもpHを求める流れは確認しておきましょう。
いかがだったでしょうか。電離平衡の計算は計算のやり方や計算結果をただ覚えようとするのではなく、弱酸と弱塩基の性質からなぜそうなるのかを理解しながら学習するようにしましょう。
(3)解説授業の内容を復習しよう
(4)電離平衡の解説一覧
①電離平衡の基本(弱酸・弱塩基の電離度とpHを求めます。近似についても解説しています)
②電離平衡で考える塩の加水分解(「塩の加水分解は存在しない」と言える理由、計算の進め方、水のイオン積についても解説しています)
③緩衝液①(緩衝液とは何か、緩衝液のイメージ、緩衝液の計算方針について解説しています)
④緩衝液②(緩衝液の計算、緩衝液に酸を加えたときのpHの計算)
(5)参考
☆化学の解説動画・授業動画一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識テスト一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学の解説・授業・知識・演習問題一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学の語呂合わせ(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
「化学計算の王道」シリーズは『思考訓練の場としての体系化学』(GHS予備校)を参考にしています。
GHS予備校についてはこちら→https://ghs-yobikou.co.jp/
思考訓練シリーズの購入はこちら→https://ghs-yobikou.shop/
