(1)解説授業動画
☆YouTubeチャンネルの登録をよろしくお願いします→大学受験の王道チャンネル
(2)解説授業の原稿
今回は中和の計算を極めるための問題の解説を行います。
なお中和の計算の基本は理解できている前提で話を進めていくので、もし中和の計算の基本が身についていない場合は、まずそちらの解説を確認してください。
問題①:弱塩基遊離+逆滴定
それでは早速問題を確認していきます。なお今回扱う問題はすべて有効数字は2桁で答えます。
濃度不明の硫酸アンモニウム水溶液20mLに1.0mol/Lの水酸化ナトリウム水溶液20mLを加えて加熱し、発生したアンモニアを0.50mol/Lの硫酸20mLに吸収させた。そして残った硫酸を0.50mol/Lの水酸化ナトリウム水溶液で滴定したところ10mLを要した。では最初の硫酸アンモニウム水溶液に含まれている溶質の硫酸アンモニウムは何mgか求めてみましょう。ただし硫酸アンモニウムの分子量は132とします。
問題文が長くややこしく感じるかもしれませんが、順番にどのような反応が起きているかを考えていき、丁寧に中和の方程式つまり「左辺に酸から出た水素イオンの物質量=右辺に塩基から出た水酸化物イオンの物質量」の方程式を作っていけば解くことができます。
今回の問題では2種類の反応が起きており、また、2種類目の反応は2つ起きています。つまり合計3つの反応が起きているのです。それぞれ確認していきましょう。
反応①:弱塩基遊離(硫酸アンモニウムと水酸化ナトリウムの反応)
まず1つ目の反応は、硫酸アンモニウムと水酸化ナトリウムの反応です。
これは弱塩基の塩と強塩基が反応し弱塩基が発生する、いわゆる弱塩基遊離の反応です。
(NH4)2SO4+2NaOH→2NH3+2Na2SO4+2H2O
反応②:逆滴定(アンモニアと硫酸の反応⇒硫酸と水酸化ナトリウムの反応)
そして2種類目の反応は中和反応です。
酸:H2SO4
塩基:NH3とNaOH
1つ目は塩基であるアンモニアと酸である硫酸の反応、2つ目は酸である硫酸と塩基である水酸化ナトリウムといった2つの中和反応が起きています。
今回の中和反応のように、滴定のしにくい気体であるアンモニアを過剰な量の硫酸に吸収させた後、残りを濃度がわかっている水酸化ナトリウム水溶液で中和することによって、アンモニアの量を逆算するような滴定のやり方を逆滴定といいます。
つまりこの問題は、弱塩基遊離によって発生したアンモニアの量を逆滴定によって求めることで、そこからさらに戻って硫酸アンモニウムの量を求めるという問題なのです。
方程式を立てる
それでは答案を作っていきます。
(NH4)2SO4+2NaOH→2NH3+2Na2SO4+2H2O
これは先ほど確認した1つ目の反応である弱塩基遊離の化学反応式です。
そして方程式を作るために、求める硫酸アンモニウムの質量をw[mg]とし、左辺が水素イオンの物質量、右辺が水酸化物イオンの物質量の方程式を立てます。今回、酸は硫酸だけですが、塩基はアンモニアと水酸化ナトリウムの2種類あります。そのため、それぞれから出た水酸化物イオンの物質量を足し算します。
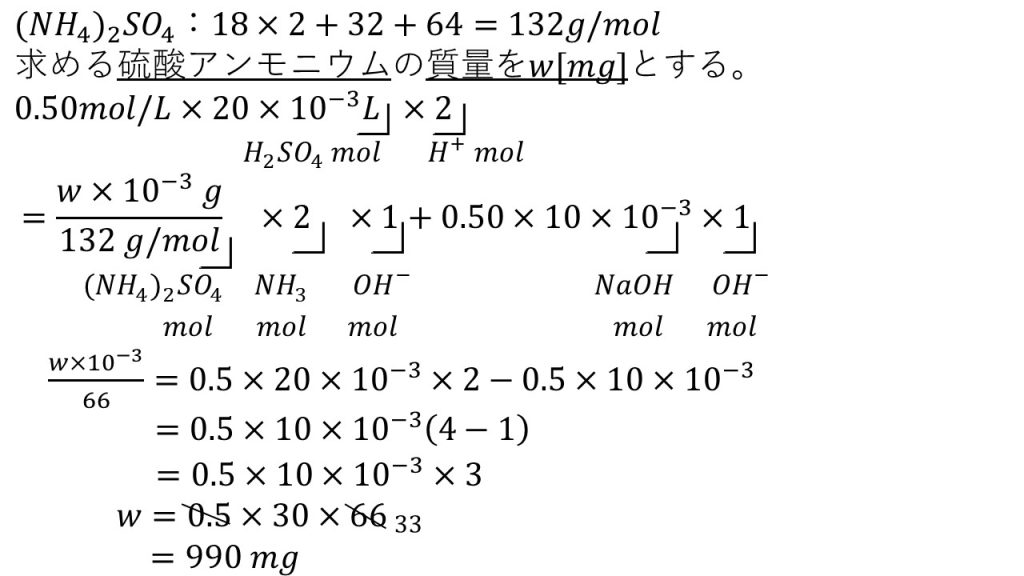
それでは、この方程式を確認していきます。
まずは硫酸のモル濃度に硫酸の体積をLにしたものをかけます。すると溶質である硫酸の物質量となります。そして硫酸は2価の酸なので×2をすることで、水素イオンの物質量となります。
続いて右辺です。まずは求めたい硫酸アンモニウムの質量をgにして硫酸アンモニウムのモル質量で割ることで、硫酸アンモニウムの物質量となります。そして、アンモニアの発生の化学反応式を見ると、硫酸アンモニウムとアンモニアの係数の比が1:2なので×2をすることでアンモニアの物質量となります。アンモニアは1価の塩基なので×1をすることで水酸化物イオンの物質量となります。
さらに、最後の中和で使った水酸化ナトリウム水溶液のモル濃度は0.50mol/Lで、それに水酸化ナトリウム水溶液の体積をかけることで、溶質である水酸化ナトリウムの物質量となります。水酸化ナトリウムは1価の塩基なので×1をすることで水酸化物イオンの物質量となります。
これで方程式ができたので、あとは計算してwを求めていきます。
ちなみに今回、硫酸アンモニウム水溶液の体積・最初に加える水酸化ナトリウム水溶液の濃度と体積の3つの量は使っていません。なぜなら1つ目の反応は中和滴定ではないので中和の式とは関係ないからです。このように、計算には不要な数字が含まれていることもあるので注意してください。
工夫しながら方程式を解く
それでは方程式を解いていきます。長い方程式ですが丁寧に工夫をしながら解いていけば、正確にかつ楽に解くことができます。
まずは求めたい文字を含む項を左辺に、それ以外を右辺に集めます。そして、右辺を因数分解できるだけ因数分解していきます。今回でいえば0.5と10と10-3をくくり出すことができます。そして残ったのが4-1で計算すると3となり、左辺の132と2を約分した後、両辺を66でかけて10-3で割り、計算すると9.9×102[mg]となります。
このように複雑に見える問題も順番に反応を考えていき、丁寧に方程式を立て工夫して解くことで、確実に解くことができるようになります。
問題②:弱酸遊離+逆滴定
続いてこの問題を解いてみます。
不純物を含む石灰石0.70gを塩酸に溶かし、発生した気体を0.10mol/Lの水酸化バリウム水溶液60mLに通した。生じた沈殿を取り除き、残った水溶液を0.050mol/L塩酸で滴定したところ15mLを要した。はじめの石灰石中の炭酸カルシウムの含有率は何パーセントか求めてみましょう。ただし炭酸カルシウムの式量は100とします。
こちらも複数の反応を扱っている問題なので複雑に感じますが、先ほどと同様に順番に反応を確認していきましょう。
この問題も2種類の反応と2種類目の反応が2つあるので計3つの反応が起きています。
反応①:弱酸遊離(炭酸カルシウムと塩酸の反応)
まず1つ目の反応は、炭酸カルシウムと塩酸の反応です。ちなみに石灰石の主成分は炭酸カルシウムであるということは知っておきましょう。
炭酸カルシウムは、弱酸である炭酸と強塩基である水酸化カルシウムの中和によってできる塩なので、弱酸の塩です。そして塩酸は強酸です。つまり、この反応は弱酸の塩と強酸を反応させると弱酸が発生する、いわゆる弱酸遊離の反応となっています。
そのため、この発生した気体というのは二酸化炭素のことです。
反応②:逆滴定(二酸化炭素と水酸化バリウムの中和反応⇒水酸化バリウムと塩酸の中和反応)
そして2つ目の反応は、二酸化炭素と水酸化バリウムの中和反応です。
ちなみに二酸化炭素は水素イオンを持っていませんが、水に溶けると2価の酸である炭酸となります。そのため二酸化炭素は酸として扱います。
また2つ目の反応の化学反応式は以下のようになります。
CO2 + Ba(OH)2 → BaCO3↓ + H2O
この反応のポイントは炭酸バリウムは沈殿するということです。詳しくは無機化学で学習するのですが、アルカリ金属以外の炭酸塩は基本的に沈殿するということは知っておきましょう。そのため生じた沈殿というのは炭酸バリウムのことなのです。
そして最後の反応は未反応の水酸化バリウムと塩酸の中和反応です。今回は酸が2つで塩基が1つの中和反応です。
ちなみに今回も気体である二酸化炭素を過剰な量の水酸化バリウム水溶液で吸収させて、残りを濃度のわかっている塩酸で滴定することによって二酸化炭素の量を逆算する、いわゆる逆滴定となっています。
つまりこの問題は、弱酸遊離によって発生した二酸化炭素の量を逆滴定によって求め、そこからさらに戻って炭酸カルシウムの量を求めるという問題なのです。
方程式を立てる
これでこの問題の反応が明らかになったので、方程式を立てて解いていきます。それでは答案を確認していきます。
CaCO3 + 2HCl → CO2 + CaCl2 + H2O
こちらの化学反応式は1つ目の反応である炭酸カルシウムと塩酸の反応の化学反応式です。
そして、求める含有率をa[%]として方程式を立てます。今回酸が2つなので、左辺はそれぞれの酸から出た水素イオンの物質量を足し算しています。

まずは不純物を含む石灰石に、含有率がa[%]なのでa/100倍することで石灰石に含まれる炭酸カルシウムの質量となります。それを炭酸カルシウムのモル質量で割ることで炭酸カルシウムの物質量となり、二酸化炭素発生の化学反応式をみると炭酸カルシウムと二酸化炭素の係数の比が1:1なので×1をすることで二酸化炭素の物質量となります。そして二酸化炭素は炭酸になると2価の酸となるので、×2をすることで水素イオンの物質量となります。
さらに、最後の滴定で使っている塩酸のモル濃度に塩酸の体積をかけることで、溶質である塩化水素の物質量となり、HClは1価の酸なので×1をすることで水素イオンの物質量となります。この2つの水素イオンの物質量を足すことで左辺となります。
次に右辺は、水酸化バリウム水溶液のモル濃度に水溶液の体積をかけることで、溶質である水酸化バリウムの物質量となり、水酸化バリウムは2価の塩基なので×2をすることで水酸化物イオンの物質量となります。
これで方程式ができたのであとはこの方程式を解いてaを求めていきます。
工夫しながら方程式を解く
まずは、左辺を求めたい文字を含む項だけにして残りを右辺に集めます。
次に右辺を因数分解ができるだけ因数分解していきます。今回は0.050と15と10-3でくくりました。すると残りは(2×4×2-1)となります。そして、かっこの中を計算すると15となります。
次にa=となるようにします。そして小数点や100倍などを整理します。0.7から小数点を1つ動かし10-1として、0.05から小数点を2つ動かすために10-2を取り出し、10-3と合わせて10-5とします。そして100が2つあるので104とします。このように小数点などは外に出しておくと計算がしやすくなります。
あとは約分をして、残ったもので先に掛け算をして、最後に割り算をして有効数字2桁になるように四捨五入をすれば答えは80%となります。
このようにこちらの問題も順番に反応を考え、そこまでで何が出ているのかを丁寧に確認しながら方程式を立てることで、確実に問題を解くことができます。
いかがだったでしょうか。入試問題は今回のように複数の反応が組み合わさって出題されます。そういった問題に対応できるようになるために今日扱った問題は復習するようにしてください。
(3)解説授業の内容を復習しよう
(4)中和と塩(理論化学)の解説一覧
②塩の加水分解と弱酸遊離の原理(弱酸の性質によって起きる現象)
③中和の計算を極める問題(複数の反応を扱った問題の解法、弱酸(弱塩基)遊離→逆滴定)
④pHの計算(対数を使った計算、pOHとの関係、水のイオン積Kwについても解説しています)
⑤塩の水溶液の液性(硫酸水素カリウムの水溶液の液性が酸性になる理由についても解説しています)
(5)参考
☆化学の解説動画・授業動画一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識テスト一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学の解説・授業・知識・演習問題一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学の語呂合わせ(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
「化学計算の王道」シリーズは『思考訓練の場としての体系化学』(GHS予備校)を参考にしています。
GHS予備校についてはこちら→https://ghs-yobikou.co.jp/
思考訓練シリーズの購入はこちら→https://ghs-yobikou.shop/
