(1)解説授業動画
☆YouTubeチャンネルの登録をよろしくお願いします→大学受験の王道チャンネル
(2)解説授業の原稿
今回は酸化還元反応の計算について解説します。
酸化還元反応の計算方法
酸化還元反応には2つの計算方法があります。
①まず1つ目は、「酸化剤が受け取った電子の物質量と、還元剤が放出した電子の物質量で方程式を作る』というやり方です。
②そして2つ目は、「イオン反応式または化学反応式の係数の比が、物質量の比になっている」という原則を使って方程式を作るやり方です。
まず1つ目の計算方法ですが、これは、酸化還元反応の原理から作った方程式です。
そもそも酸化還元反応とは、酸化剤と還元剤が電子をやり取りする反応のことです。還元剤が電子を放出し、それを酸化剤が受け取ることで、酸化還元反応が成立します。
そのため、還元剤から出てくる電子の量と、酸化剤が受け取る電子の量は等しくなるため、この方程式が成り立ちます。
そして2つ目の計算方法ですが、これは酸化還元反応だけでなく、化学反応式があればどのような反応でも成り立つ原則です。
このように2つの計算方法があるわけですが、原理的には1つ目の計算方法で計算するべきです。
しかしこちらの計算方法で計算するためには、酸化剤と還元剤の半反応式が必要となるのですが、半反応式からイオン反応式にするのは容易なことで、特に時間も手間もかかりません。そのため、1つ目の計算方法で計算できる状況であれば、2つ目の計算方法でも計算できるようになるので、どちらの計算方法でも労力の差はありません。
さらに酸化還元反応の問題では、化学反応式の作成を要求することが多く、結局、化学反応式を作るのであれば、ついでにこちらのやり方で計算してしまってもいいでしょう。
つまりこの2つの計算方法は、どちらが良いとか、あるいは状況によって使い分けようといったものではなく、自分がやりやすい方を選べば良い、というものなのです。
今回はこれらの計算方法を両方とも試してみようと思います。
例題
それでは問題を解いてみます。
硫酸鉄(Ⅱ)水溶液25mLを硫酸で酸性にした後、0.020mol/Lの過マンガン酸カリウム水溶液を滴下したところ、20mLで滴定の終点に達した。
この問題設定に対して、以下の2つの設問があります。
- 滴定の終点は溶液の色がどのように変化するときかを説明します。
- 硫酸鉄(Ⅱ)水溶液のモル濃度を求めます。
なお今回は、化学反応式を作る問題を扱いません。もし酸化還元反応の化学反応式の作り方を確認したい場合は、別の動画で詳しく解説しているので、そちらをご覧になってください。
設問①:滴定の終点
それではまず1問目から解きます。この問題は計算問題ではないのですが、知っておいてほしいので問題に入れました。滴定の終点をどのように判断するかという問題です。
過マンガン酸イオンの特徴
まず知っておかないといけないのは、過マンガン酸カリウムは水溶液中で電離して、カリウムイオンと過マンガン酸イオンに分かれています。
そして過マンガン酸イオンの色は赤紫色です。これは重要なので必ず覚えておきましょう。
過マンガン酸イオンの色は濃い赤紫色なので、少量でも過マンガン酸イオンが含まれているかどうかが分かりやすいので、酸化還元反応の滴定によく使われるのです。
設問の答え
よくこの問題を何も考えずに「赤紫色から無色に変わったとき」と答えてしまう人がいますが、これは間違いです。
よく問題を読んで状況を確認してください。問題文に「過マンガン酸カリウム水溶液を滴下した」と書いてあるので、滴下する方が過マンガン酸カリウム水溶液であり、滴下される方が硫酸鉄(Ⅱ)水溶液となります。

そのため、答えは「無色から赤紫色になり、その赤紫色が消えなくなったとき」が、滴定の終点となります。
「赤紫色が消えなくなったとき」の意味
この「赤紫色が消えなくなったとき」というのも重要です。
溶液に過マンガン酸カリウム水溶液を滴下した後、かき混ぜたりなどして色が消えた場合は、まだ過マンガン酸イオンと鉄イオンが反応しているということなので、反応の終点ではありません。
それを繰り返して、かき混ぜても赤紫色が消えなくなったら、反応していない過マンガン酸イオンが存在するということなので、それはつまり溶液の中の鉄イオンが無くなったと言うことであり、その瞬間が滴定の終点となるのです。
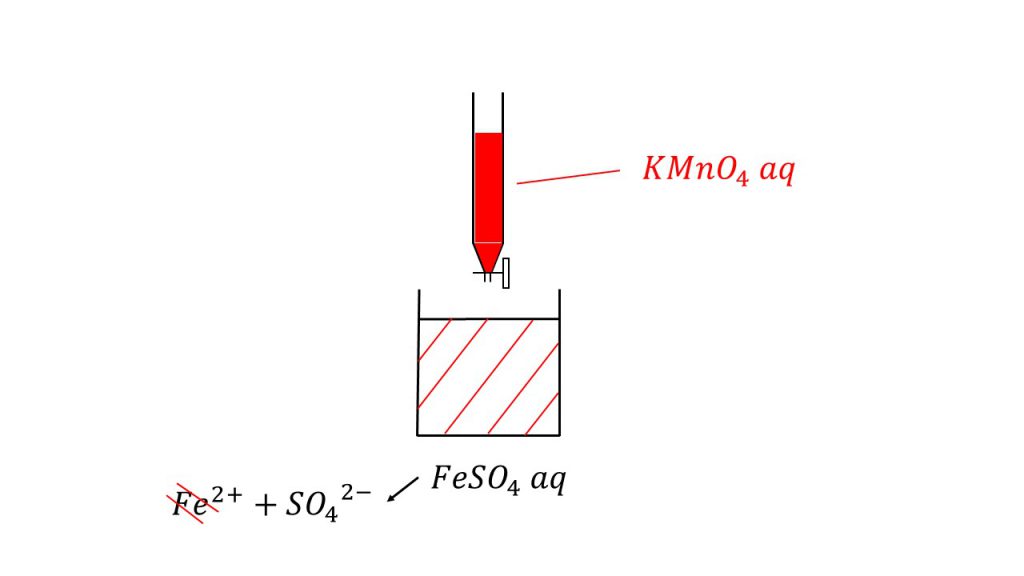
ちなみに厳密なことを言えば鉄(Ⅱ)イオンは、薄い緑色をしています。そのため実際は、完全な無色ではありません。
しかし、鉄(Ⅱ)イオンの色は、過マンガン酸イオンの赤紫色に比べてとても薄く、わかりにくい微妙な色をしており、さらに今回は、濃度も小さいので無色としても問題ないと思います。もし気になる方がいれば、ほぼ無色とするか、とても薄い緑色としておけばよいでしょう。
この問題に関しては、鉄(Ⅱ)イオンの厳密な色よりも、過マンガン酸イオンによる溶液の色の変化や滴定の終点をどのように判断するか、といったことのほうが重要です。
設問②:酸化還元反応の計算問題
それでは計算問題を解いていきます。
酸化剤と還元剤の半反応式
2つのやり方のどちらで解くにしても、酸化剤と還元剤の半反応式が必要なので、まずは半反応式を作っていきます。
左辺に反応物、右辺に生成物を書き、過マンガン酸イオンの中のマンガンの酸化数を確認し 、マンガンイオンの酸化数を確認します。すると+7から+2に減っているので、酸化剤は電子を5個受け取ったということになります。
次に、両辺の電荷が釣り合うように水素イオンを加えます。左辺は過マンガン酸イオンの電荷が-1で、-1の電子が5個あるので合計-6となっています。右辺はマンガンイオンの価数の+2となります。よって、両辺の電荷を釣り合わせるために左辺に水素イオンを8つ加えます。そうすることで、両辺の電荷が釣り合います。
最後に、両辺の HとOの数をそろえるために、右辺にH2Oを4つ加えます。これで酸化剤の半反応式が完成しました。
次に還元剤の半反応式を作ります。
まずは左辺に反応物である鉄(Ⅱ)イオンを書き、右辺に生成物である鉄(Ⅲ)イオンを書きます。酸化数が+2から+3に変化しているので、右辺に電子を1つ加えれば、還元剤の半反応式が完成します。
計算方針①:酸化剤が受け取った電子の物質量=還元剤が放出した電子の物質量
これで半反応式が出来たので、まずは1つ目の計算方針の「酸化剤が受け取った電子の物質量=還元剤が放出した電子の物質量」で方程式を作っていきます。
まずは方程式を作るために、求める硫酸鉄(Ⅱ)水溶液のモル濃度をCとおきます。

左辺は酸化剤が受け取った電子にするので、まずは酸化剤である過マンガン酸カリウム水溶液のモル濃度に、過マンガン酸カリウム水溶液の体積をかけます。すると、過マンガン酸カリウム、つまり過マンガン酸イオンのモルとなります。
そして半反応式を見ると、過マンガン酸イオンと電子の係数の比が1:5となっているので、物質量の比も1:5となっています。そのため、過マンガン酸イオンのモルに、×5をすることで、電子の物質量となるのです。
これで左辺が出来たので、次は右辺を作っていきます。
右辺も同様に、硫酸鉄(Ⅱ)水溶液のモル濃度に、硫酸鉄(Ⅱ)水溶液の体積をかけることで、溶質である硫酸鉄、つまり鉄(Ⅱ)イオンの物質量となります。
そして還元剤の半反応式を見ると、鉄(Ⅱ)イオンと電子の係数の比は1:1なので、物質量の比も1:1ということであり、鉄(Ⅱ)イオンの物質量に×1をすることで、電子の物質量となります。
そして、この反応は酸化還元反応なので、酸化剤が受け取った電子の物質量と、還元剤が放出する電子の物質量は等しくなります。
これで方程式が出来たので、あとは方程式を解いて答えを出します。
方程式を解くときは、まず左辺を求めたい文字だけにして、残りを右辺に集めます。そして約分できるだけ約分をしていき、残ったものだけで計算すれば、答えは8.0×10-2mol/Lとなります。
1つ目の計算方針である「酸化剤が受け取った電子の物質量=還元剤が放出した電子の物質量」で方程式を立てるやり方はこのようになります。
計算方針②:イオン反応式の係数を使ったやり方
続いて、同じ問題を2つ目の計算方針である、イオン反応式の係数を使ったやり方で解いてみます。
まず半反応式からイオン反応式を作ります。
酸化剤の電子の係数が5で、還元剤の電子の係数が1なので、還元剤の両辺を5倍して2つの反応式を足し合わせます。
MnO4– + 8H+ + 5Fe2+ → Mn2+ + 4H2O + 5Fe3+
これがイオン反応式です。
そして、計算問題を解くだけであれば、イオン反応式までで十分です。つまり、酸化還元反応の計算に、酸化還元反応の化学反応式はいらないので作る必要はないということです。
それでは方程式を作っていきます。
先ほどと同様に、求める硫酸鉄(Ⅱ)水溶液のモル濃度をC[mol/L]とおき、方程式を作ります。
C×25×10-3×5=0.020×20×10-3
これがイオン反応式の係数の比から作った方程式です。
過マンガン酸カリウム水溶液のモル濃度に、過マンガン酸カリウム水溶液の体積をかけることで、溶質の過マンガン酸カリウム、つまり過マンガン酸イオンの物質量となります。
そして、イオン反応式を見ると、過マンガン酸イオンと鉄(Ⅱ)イオンの、係数の比は1:5であるので、×5をすることで、鉄(Ⅱ)イオンの物質量となります。
そして方程式なので、右辺も鉄(Ⅱ)イオンの物質量となるようにします。
まずは、硫酸鉄水溶液のモル濃度に、硫酸鉄水溶液の体積をかけることで、溶質の硫酸鉄、つまり鉄(Ⅱ)イオンの物質量となります。
これで両辺が鉄(Ⅱ)イオンの物質量となったので、イコールで結べば方程式の完成です。 計算は先ほどとまったく同じものになり、答えも当然同じものとなります。
今回は鉄(Ⅱ)イオンの物質量で方程式を作りましたが、過マンガン酸イオンの物質量で方程式を作ることもできます。その場合は、鉄(Ⅱ)イオンの物質量を1/5倍することになります。
あるいは「過マンガン酸イオンの物質量:鉄(Ⅱ)イオンの物質量=1:5」といった比例式を作ってから方程式を作る、というやり方もできます。
どのやり方でやっても、結局同じ計算の同じ答えとなるので、自分がやりやすいやり方でやるようにしましょう。
(3)解説授業の内容を復習しよう
(4)酸化還元反応の計算の解説
①酸化還元反応の計算(過マンガン酸イオンの色、滴定の終点についての解説もしています)
②酸化還元反応の化学反応式の作り方(硫酸酸性の過マンガン酸カリウムと硫酸鉄(Ⅱ)の反応)
③ヨウ素滴定の解説(チオ硫酸イオンとは何か、ヨウ素デンプン反応についても解説しています)
(5)参考
☆酸化還元反応と金属のイオン化傾向(化学基礎)の解説・授業・知識・演習問題一覧
☆化学の解説動画・授業動画一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識テスト一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学の解説・授業・知識・演習問題一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学の語呂合わせ(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
「化学計算の王道」シリーズは『思考訓練の場としての体系化学』(GHS予備校)を参考にしています。
GHS予備校についてはこちら→https://ghs-yobikou.co.jp/
思考訓練シリーズの購入はこちら→https://ghs-yobikou.shop/
