☆問題のみはこちら→中和の計算(応用)、pHの計算(問題)
☆解説授業①:塩の加水分解と弱酸遊離の原理(弱酸の性質によって起きる現象)
☆解説授業②:中和の計算を極める問題(複数の反応を扱った問題の解法、弱酸(弱塩基)遊離→逆滴定)
☆解説授業③:pHの計算(対数を使った計算、pOHとの関係、水のイオン積Kwについても解説しています)
☆解説授業④:塩の水溶液の液性(硫酸水素カリウムの水溶液の液性が酸性になる理由についても解説しています)
※原子量:H=1, C=12, N=14, O=16, Na=23, S=32, Ca=40
※log102=0.301, log103=0.477, log101.3=0.114
※①②は有効数字2桁で、③は有効数字3桁で答えよ。
①濃度不明の硫酸アンモニウム水溶液の濃度を次のような方法で求めた。まずこの水溶液20mLに1.0mol/Lの水酸化ナトリウム水溶液20mLを加えて加熱し、発生したアンモニアを0.50mol/Lの硫酸20mLに完全に吸収させた。続いて残った硫酸を、0.50mol/Lの水酸化ナトリウム水溶液で滴定したところ10mLを要した。
1)アンモニアが気体として発生する反応を化学反応式で表せ。

2)はじめの硫酸アンモニウム水溶液20mL中に含まれる硫酸アンモニウムは何mgであったか。
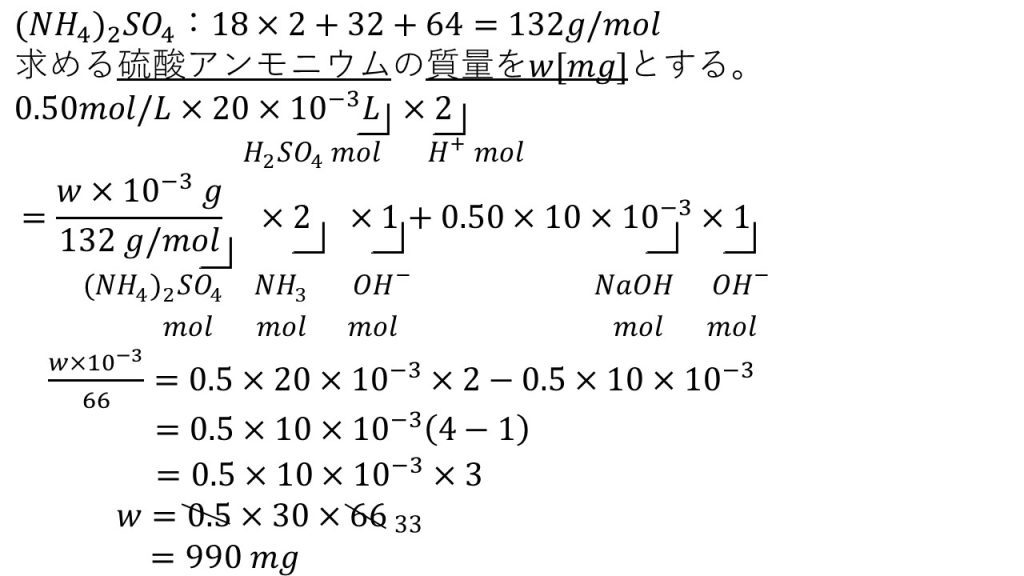
②不純物を含む石灰石0.70gを塩酸に溶解し、発生した気体を0.10mol/Lの水酸化バリウム水溶液60mLに通した。生じた沈殿を除き、残った水溶液を0.050mol/Lの塩酸で滴定したところ15mLを要した。
1)発生した気体、および生じた沈殿は何か。それぞれの化学反応式とともに示せ。

2)はじめの石灰石中の炭酸カルシウムの含有率[%]を求めよ。

③次の水溶液のpHを求めよ。ただし水溶液の温度は25℃とする(水のイオン積Kw=1.0×10ー14[mol2/L2])
1)5.00×10-3mol/Lの硫酸
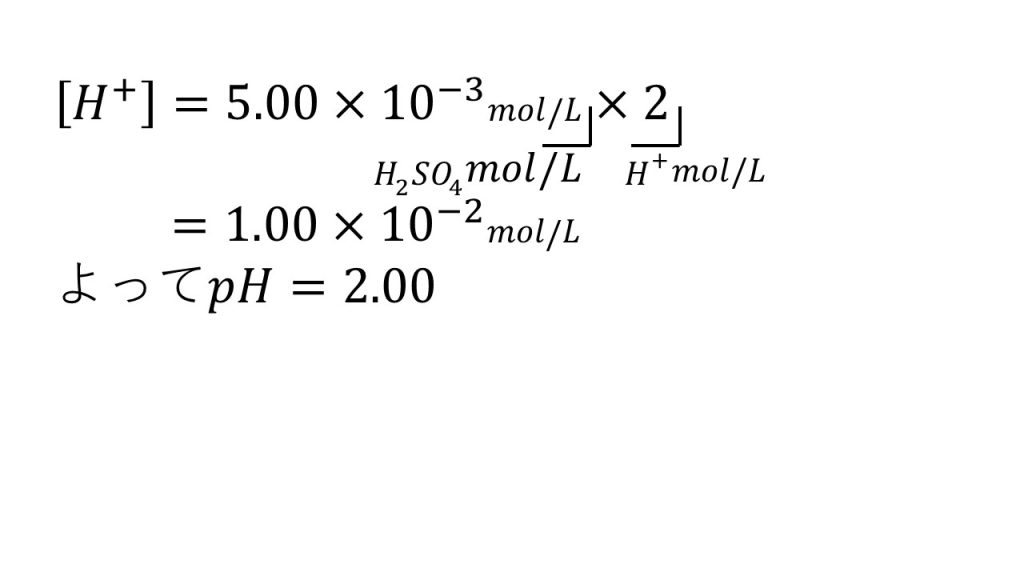
2)0.100mol/Lの硫酸
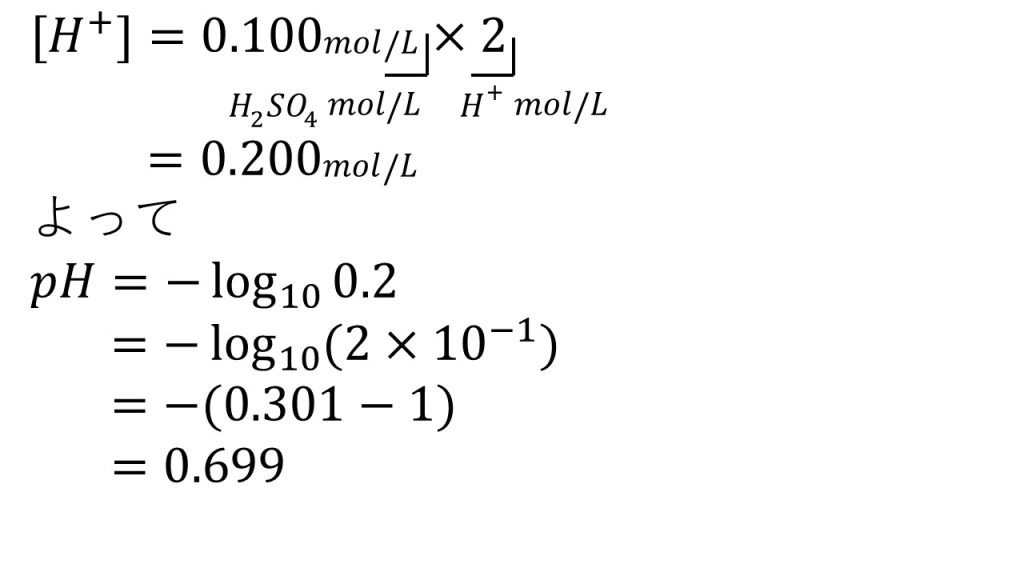
3)1.00×10-2mol/Lの水酸化ナトリウム水溶液
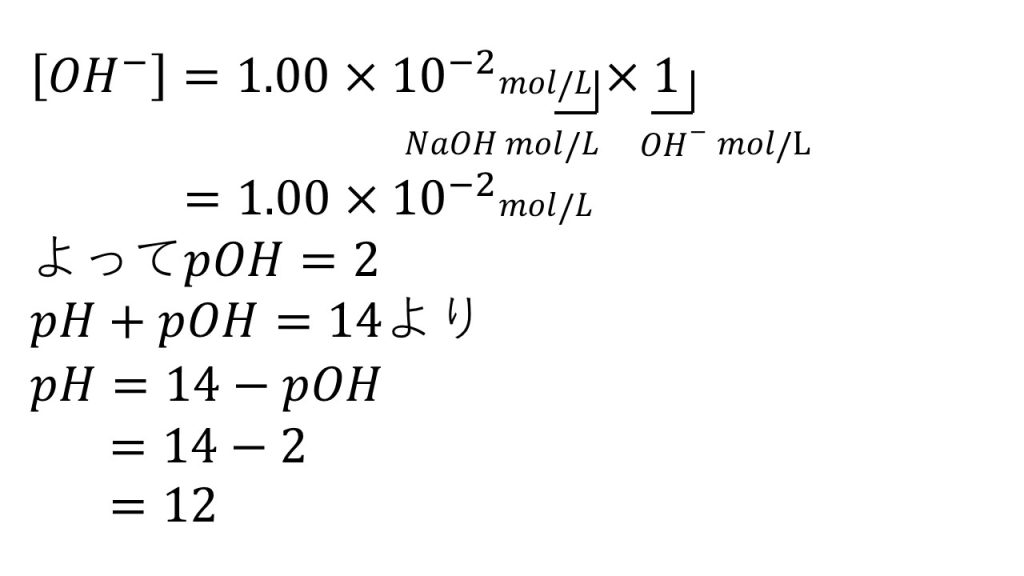
4)0.00100mol/Lの水酸化バリウム水溶液

5)0.100mol/Lの酢酸水溶液 (ただし、電離度α=0.01)
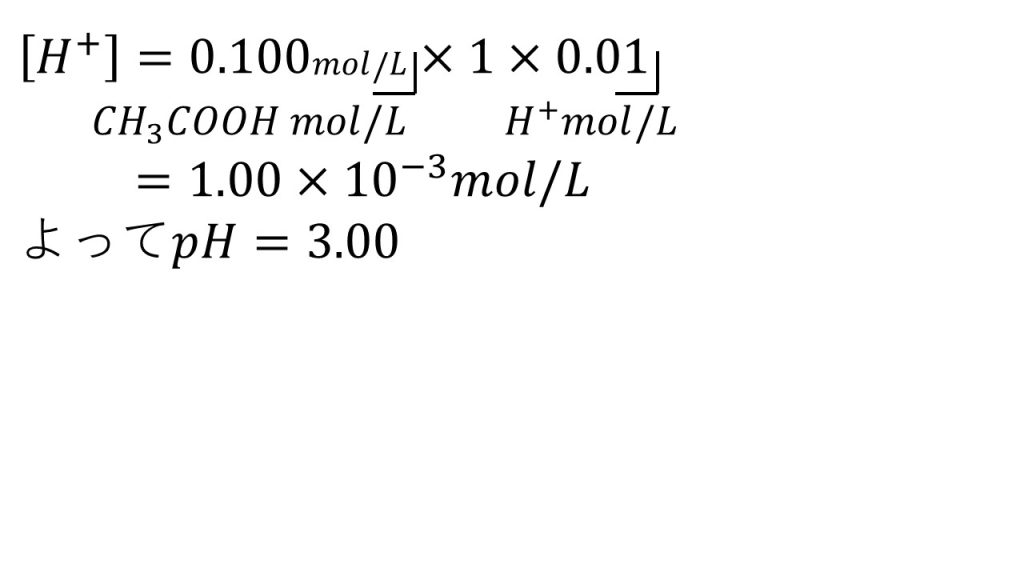
6)0.100mol/Lのアンモニア水 (ただし、電離度α=0.013)
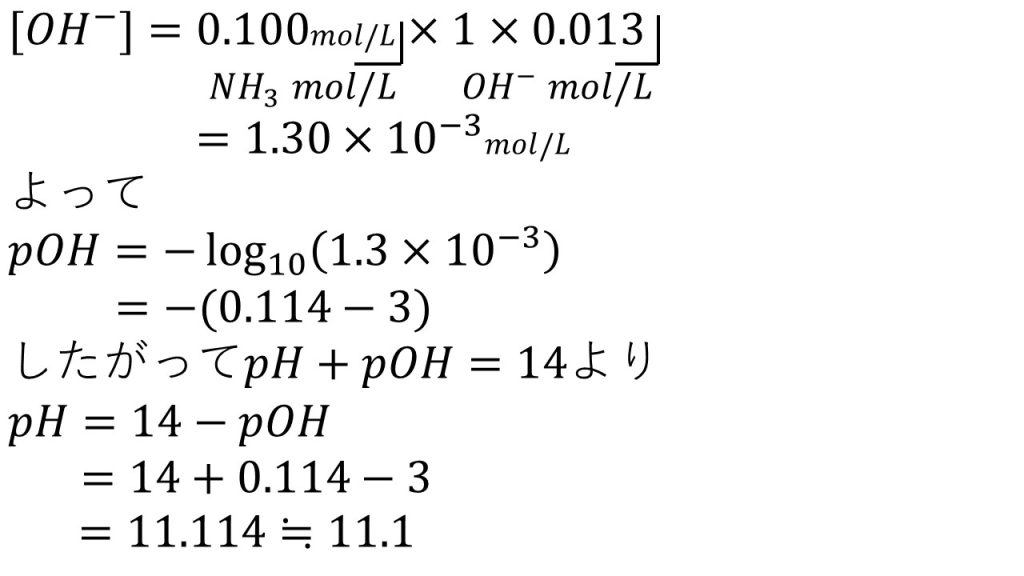
④次に示す塩について問いに答えよ。
ア:NaHCO3 イ:KNO3 ウ:(NH4)2SO4 エ:CuSO4 オ:KHSO4 カ:Na2CO3 キ:CH3COONa ク:Al2(SO4)3 ケ:NaCl
1)水溶液が中性であるものはどれか。
2)水溶液が酸性を示すものはどれか。
3)水溶液が塩基性を示すものはどれか。

☆問題のみはこちら→中和の計算(応用)、pHの計算(問題)
【解説授業】
①塩の加水分解と弱酸遊離の原理(弱酸の性質によって起きる現象)
②中和の計算を極める問題(複数の反応を扱った問題の解法、弱酸(弱塩基)遊離→逆滴定)
③pHの計算(対数を使った計算、pOHとの関係、水のイオン積Kwについても解説しています)
④塩の水溶液の液性(硫酸水素カリウムの水溶液の液性が酸性になる理由についても解説しています)
【その他参考になる解説】
②電離平衡の基本(弱酸・弱塩基の電離度とpHを求めます。近似についても解説しています)
「化学計算の王道」シリーズは『思考訓練の場としての体系化学』(GHS予備校)を参考にしています。
GHS予備校についてはこちら→https://ghs-yobikou.co.jp/
思考訓練シリーズの購入はこちら→https://ghs-yobikou.shop/
~参考~
☆化学計算の王道(化学基礎・理論化学) ←その他の単元の計算問題と解説はこちら
☆化学の解説動画・授業動画一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識テスト一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学の解説・授業・知識・演習問題一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
