(1)解説授業動画
☆YouTubeチャンネルの登録をよろしくお願いします→大学受験の王道チャンネル
(2)解説授業の原稿
酸化数直線とは
「酸化数直線」とは、そう呼んでいる人がいるという言葉なので、教科書に載っている言葉ではありません。しかし知っておくと酸化還元反応をより理解しやすくなります。
酸化数直線とは酸化数の上限と下限を数直線に表したものです。
この酸化数直線をかくようにすれば、酸化剤になるのか還元剤になるのか、あるいは酸化還元反応のあとにどういった物質になるのかが分かりやすくなります。
塩素の酸化数直線
例えば、塩素の酸化数直線をかいてみます。
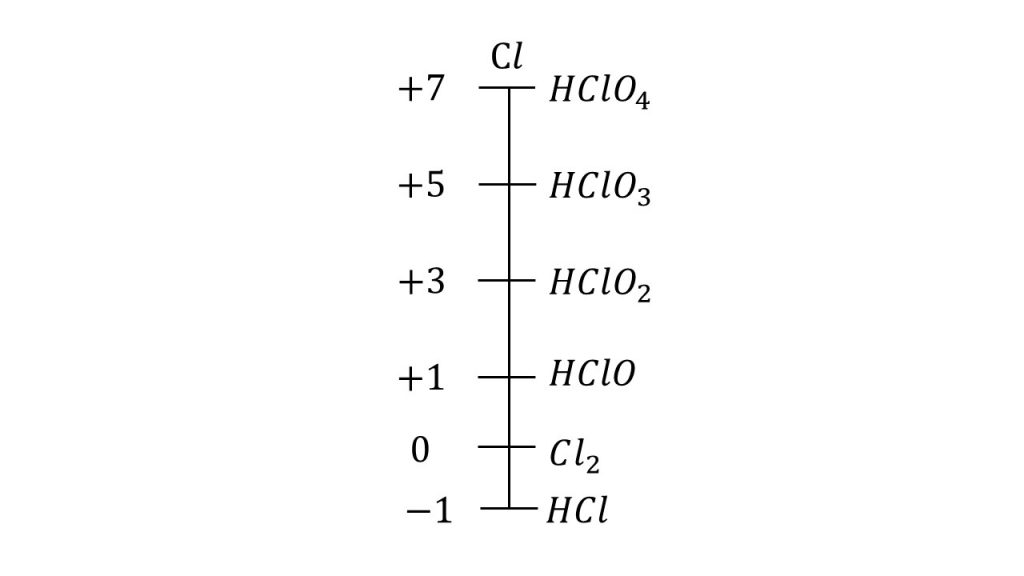
左側に塩素のとり得る酸化数が書いてあり、右側にその酸化数のときの代表的な物質が書いてあります。
塩素の酸化数の最大値と最小値
塩素はハロゲン、つまり17族なので価電子は7個です。そのため放出できる電子の最大値が7であるため酸化数の上限は+7となります。
また、価電子が7ということは、電子を最大1個まで受け入れることができるということなので、酸化数の最小値は-1となります。
このように価電子の数を考えると酸化数の最大値と最小値が分かります。
それぞれの酸化数における代表的な物質
また、それぞれの酸化数における代表的な物質を確認します。
特に注意したいのは、塩酸が一番下にあるということです。
塩酸のときの塩素の酸化数は-1であり、酸化数直線の一番下に位置しています。つまり、これ以上酸化数が小さくなることはないので塩酸の中の塩素の酸化数は増加、つまり酸化されるしかなく、塩酸は還元剤として働きます。
塩酸は強酸ではあるのですが、酸化剤ではなく還元剤であるということはとても重要なので知っておきましょう。
またHClO3のことを塩素酸といい、それにさらに1つOが増えているので、HClO4のことを過塩素酸といい、塩素酸よりも酸素が1個少ないので、HClO2のことを亜塩素酸といい、それよりもさらに1個酸素が少ないので、HClOのことを次亜塩素酸といいます。
これらもついでに覚えておきましょう。
硫黄の酸化数直線
続いて硫黄の酸化数直線です。

硫黄の酸化数の最大値と最小値
硫黄は16族なので価電子が6個です。そのため放出できる電子の数が最大で6個なので酸化数の上限は+6となります。
また価電子が6個ということは、最大で2個まで電子を受け取ることができるので酸化数の最小値は-2となります。
それぞれの酸化数における代表的な物質
また、それぞれの酸化数での代表的な物質を確認します。
硫化水素は酸化数直線の一番下にいるので、酸化数が増加、つまり自身は酸化されるしかないので、相手を還元する還元剤となり、逆に硫酸は酸化数直線の一番上にいるので自身は還元されるしかなく、相手を酸化させる酸化剤として働くということが、この数直線から分かります。
また硫化水素が還元剤として働いた場合、硫黄が生成し、硫酸が酸化剤として働いた場合二酸化硫黄が生成されるということもこの数直線から分かります。ちなみに硫酸を酸化剤として働かせるためには、熱濃硫酸にしなければならないということも覚えておきましょう。
さらに二酸化硫黄の位置を見てみると、酸化させられて硫酸となったり、還元されて硫黄となったりすることができると分かります。つまり二酸化硫黄は酸化剤としても還元剤としても働くことができるということになります。
窒素の酸化数直線
最後に窒素の酸化数直線を見てみましょう。
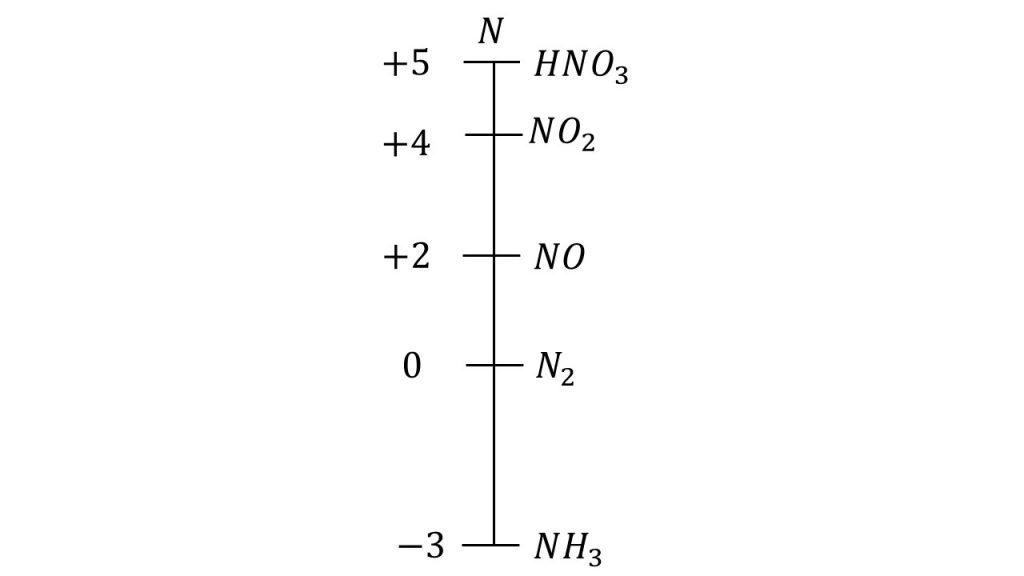
窒素の酸化数の最大値と最小値
窒素は15族なので、価電子が5個となります。
つまり放出できる電子の最大数は5個であるので酸化数の上限は+5となり、3個まで電子を受け取ることができるので、酸化数の下限は-3となります。
それぞれの酸化数における代表的な物質
それぞれの酸化数での代表的な物質を確認します。
酸化数直線の一番下にあるアンモニアは還元剤として働き、一番上にいる硝酸は酸化剤として働きます。
硝酸が酸化剤として働いた場合、生成する物質は2通りあります。濃硝酸のときはNO2、希硝酸のときはNOが生成します。
このように条件によっては数直線の隣に行くのではなく、飛ばしてその次の物質に変化することもあります。そのため酸化数直線を使って生成物を考えるときは必ずしも隣に移るわけではないということに注意してください。
(3)解説授業の内容を復習しよう
④17族、ハロゲン、フッ素F、塩素Cl、臭素Br、ヨウ素I(無機化学)知識テスト
(4)酸化還元反応(理論化学)の解説一覧
①酸化還元反応の化学反応式の作り方(硫酸酸性の過マンガン酸カリウムと硫酸鉄(Ⅱ)の反応)
②酸化還元反応の計算(過マンガン酸イオンの色、滴定の終点についての解説もしています)
③金属のイオン化傾向を完全に理解しよう(水との反応・酸との反応)
④「酸化数直線」を知っておくと酸化還元反応をより理解できる(塩素・硫黄・窒素の酸化還元反応)
⑤「鉄の製錬」完全解説(原料と生成物、製錬の過程(反応式)、石灰石の役割、還元の過程、四酸化三鉄についても解説しています)
⑥銅の酸化還元反応の化学反応式(銅と熱濃硫酸、銅と希硝酸、銅と濃硝酸)
⑦銀の酸化還元反応の化学反応式(銀と熱濃硫酸、銀と希硝酸、銀と濃硝酸)
⑧ヨウ素滴定の解説(チオ硫酸イオンとは何か、ヨウ素デンプン反応についても解説しています)
(5)参考
☆化学の解説動画・授業動画一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識テスト一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学の解説・授業・知識・演習問題一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
