(1)解説授業動画
☆YouTubeチャンネルの登録をよろしくお願いします→大学受験の王道チャンネル
(2)解説授業の原稿
鉄の製錬において重要なポイント
今回は鉄の製錬について解説します。
鉄の製錬とは鉄鉱石から単体の鉄を得る方法のことです。
鉄の製錬において重要なポイントが2つあります。
①原料や生成物の物質名を知っておくということ、
②鉄の製錬とは酸化鉄(Ⅲ)から単体の鉄までの還元の過程であるということを理解しておくこと
この2点が重要です。
鉄の製錬の原料
それでは、まず原料と生成物を確認します。
鉄の製錬は、下図のような溶鉱炉という設備で行います。
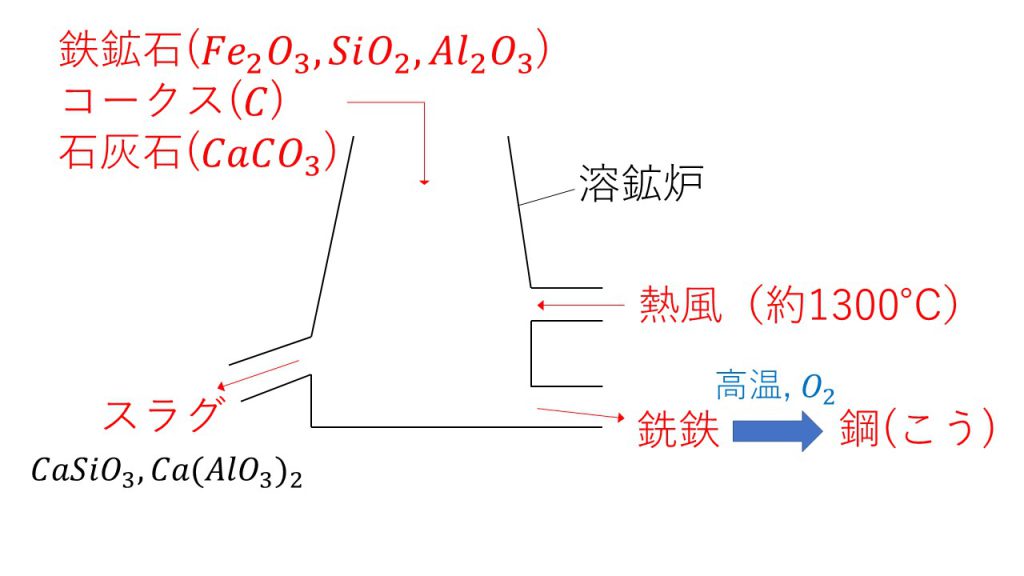
原料は、鉄鉱石とコークスと石灰石の3つです。
鉄鉱石の主成分は酸化鉄(Ⅲ)Fe2O3で、不純物として二酸化ケイ素SiO2や酸化アルミニウムAl2O3が含まれています。コークスとは炭素Cのことで、酸化鉄(Ⅲ)を還元させる働きがあります。そして、石灰石は炭酸カルシウムCaCO3のことです。なぜ石灰石を混ぜるのかについては後ほど解説します。
鉄の製錬の過程の反応式
これらの原料を溶鉱炉に入れ、約1300℃の熱風を吹き込むと、
①Fe2O3 + 3CO → 2Fe + 3CO2
②Fe2O3 + 3C → 2Fe + 3CO
この2つの反応が起き、酸化鉄(Ⅲ)から単体の鉄を得ることができます。この2つの反応はどちらも酸化還元反応になっています。
それぞれの反応の鉄と炭素の酸化数を調べてみると、鉄は①の反応でも②の反応でも+3から0に減少しており、酸化数が減少しているということは還元されたということになります。それに対して炭素は、①の反応では+2から+4に、②の反応では0から+2に増加しており、酸化数が増加しているということは酸化されたということになります。
この2つの酸化還元反応によって、単体の鉄を得ているのです。
鉄の製錬における還元剤
②の反応の還元剤であるC(炭素)はコークスのことですが、①の反応の還元剤であるCO(一酸化炭素)はどこから来たかというと、溶鉱炉の中で、
CO2 + C → 2CO
この反応式のように、二酸化炭素とコークスが反応することによって一酸化炭素が発生しているのです。
では、このCO2(二酸化炭素)はどこから来たかというと、熱風によってコークスが燃焼して生じたものと、石灰石(炭酸カルシウム)が熱風によって熱分解して生じたものの2つから来ているのです。
C + O2 → CO2
CaCO3 → CaO + CO2
この二酸化炭素を供給するというのが石灰石の1つ目の役割です。
このようにして二酸化炭素を発生させて、その二酸化炭素が一酸化炭素になって、そして、一酸化炭素が還元剤として鉄を還元させているのです。
①Fe2O3 + 3CO → 2Fe + 3CO2
②Fe2O3 + 3C → 2Fe + 3CO
一酸化炭素による還元(①の反応)のことを間接還元といい、炭素(コークス)による還元(②の反応)は直接還元といいます。溶鉱炉の中ではこの2つの反応が起きているわけですが、実際の溶鉱炉の中では60~70%は間接還元が起きています。
銑鉄と鋼
そして、溶鉱炉内でのこのような反応によってできた鉄のことを、銑鉄(せんてつ)と言います。銑鉄は炭素を4%ほど含んでおり、炭素の量が多すぎるため、もろくて割れやすいです。
※銑鉄は鋳物(鋳型に流し込んで作る鉄製品)に使用されています。
そのため、銑鉄に高温の酸素を吹き込んで炭素を除去する必要があります。
このようにして、炭素の割合を2パーセント以下にした鉄のことを鋼(こう)と言います。この鋼は炭素の割合が少ないので粘り強い性質を持っており、これが製品として出荷されています。ちなみに、炭素の割合を変えることによって性質を変えることができるので、用途に応じて炭素の割合を変えています。
| 鋼の種類 | 極軟鋼 | 軟鋼 | 硬鋼 | 最硬鋼 |
| 炭素の割合 | 0.12%以下 | 0.40%以下 | 0.8.%以下 | 0.80%以上 |
| 製品用途 | トタン、ブリキ、 針金、釘 | 鉄骨、鉄筋 | 車軸、ボルト、 機械部品 | レール、ワイヤー、 ばね、刃物 |
スラグ
また、鉄の製錬によって銑鉄だけでなくスラグという物質も生成します。スラグは鉄鉱石に含まれる不純物(二酸化ケイ素や酸化アルミニウム)と、石灰石(炭酸カルシウム)の熱分解によって生じた酸化カルシウムが反応してできます。
スラグの化学式は、CaSiO3(ケイ酸カルシウム)やCa(AlO2)2(アルミン酸カルシウム)となりますが、これらは覚える必要はありません。
スラグに関しては、スラグはただのゴミではなく、セメントの原料になるということは知っておきましょう。
※セメントは、石灰石と粘土の約5:1の混合物に、ケイ石(SiO2)とスラグを加えて粉砕し、約1500℃で焼いた後に冷却し、それにセッコウ(CaSO4・2H2O)を混ぜて、再び細かく粉砕したものです。
以上が鉄の製錬の原料と過程の反応と生成物になります。
酸化鉄(Ⅲ)から単体の鉄までの還元の過程
それでは、次に鉄の製錬は酸化鉄(Ⅲ)から単体の鉄までの還元の過程であるということを解説します。
先ほど、
Fe2O3 + 3CO → 2Fe + 3CO2
Fe2O3 + 3C → 2Fe + 3CO
このような酸化還元反応によって鉄の製錬が行われていると解説しましたが、これらの化学反応式は、鉄の製錬全体の化学反応式で、実際は
Fe2O3 → Fe3O4 → FeO → Fe
このように段階を踏んで、酸化鉄(Ⅲ)が単体の鉄に還元されます。順番としては、酸化鉄(Ⅲ)から始まり、次に四酸化三鉄になり、その次に酸化鉄(Ⅱ)となって、単体の鉄となります。
まずポイントとなるのは、鉄の製錬は還元の過程なので、酸化数が減っているということです。酸化鉄(Ⅲ)の鉄の酸化数は+3で、酸化鉄(Ⅱ)の鉄の酸化数は+2になり、単体の鉄の酸化数は0となります。
また、四酸化三鉄は化学式をFe3O4と書くことが多いのですが、FeO・Fe2O3のように書くこともあります。このことからも分かる通り、四酸化三鉄は酸化鉄(Ⅱ)FeOと酸化鉄(Ⅲ)Fe2O3を合わせた物質なのです。そのため、還元の段階としては酸化鉄(Ⅲ)と酸化鉄(Ⅱ)の間に位置することになります。
この還元の段階の順番は、試験で問われることが多いのですが、酸化数が減っているということと、四酸化三鉄の正体を知っておけば、もう順番で迷う必要はなくなります。
以上が鉄の製錬において知っておきたい知識です。ぜひ復習しておいてください。
(3)解説授業の内容を復習しよう
(4)工業的製法の解説授業一覧
①アルミニウムの溶融塩電解(そもそも溶融塩電解とは何か、なぜ水を使ってはいけないのか、氷晶石、クラーク数などについても解説しています)
②「鉄の製錬」完全解説(原料と生成物、製錬の過程(反応式)、石灰石の役割、還元の過程、四酸化三鉄についても解説しています)
③「銅の電解精錬」完全解説(黄銅鉱から粗銅への製錬、粗銅が陽極で純銅が陰極の理由、不純物の酸化、陽極泥、計算問題の考え方、銅の電解精錬特有の式の立て方についても解説しています)
④ハーバー・ボッシュ法の解説(なぜ高温高圧で行うのか、なぜ人類にとって重要なのか)
(5)酸化還元反応の解説授業一覧
①酸化還元反応の化学反応式の作り方(硫酸酸性の過マンガン酸カリウムと硫酸鉄(Ⅱ)の反応)
②酸化還元反応の計算(過マンガン酸イオンの色、滴定の終点についての解説もしています)
③金属のイオン化傾向を完全に理解しよう(水との反応・酸との反応)
④「酸化数直線」を知っておくと酸化還元反応をより理解できる(塩素・硫黄・窒素の酸化還元反応)
⑤「鉄の製錬」完全解説(原料と生成物、製錬の過程(反応式)、石灰石の役割、還元の過程、四酸化三鉄についても解説しています)
⑥銅の酸化還元反応の化学反応式(銅と熱濃硫酸、銅と希硝酸、銅と濃硝酸)
⑦銀の酸化還元反応の化学反応式(銀と熱濃硫酸、銀と希硝酸、銀と濃硝酸)
⑧ヨウ素滴定の解説(チオ硫酸イオンとは何か、ヨウ素デンプン反応についても解説しています)
(6)参考
☆化学の解説動画・授業動画一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識テスト一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学の解説・授業・知識・演習問題一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
