(1)解説授業動画
☆YouTubeチャンネルの登録をよろしくお願いします→大学受験の王道チャンネル
(2)解説授業の原稿
今回は電気分解の計算について解説します。
電気分解とは何か
まずはそもそも電気分解とは何かについて確認します。
電気分解とは電池によって電子を移動させ、強制的に酸化還元反応を起こすことです。ポイントは、電池を使って無理やり電子を移動させることによって、自然では起きることのない酸化還元反応を無理やり引き起こすのです。
例えば下図のように電気分解をしたとします。
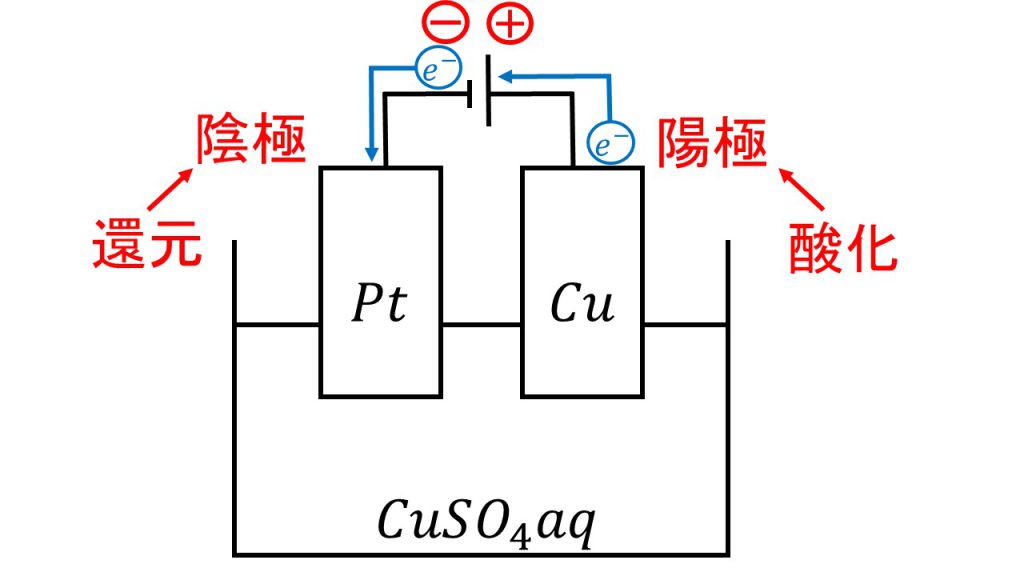
電池の負極にプラチナ(Pt)をつなぎ、電池の正極に銅をつなぎ、この2つの電極を硫酸銅水溶液に入れたとします。
電池の負極側につながっている電極のことを陰極といい、電池の正極側につながっている電極のことを陽極と呼びます。
電子は電池の負極側から出て電池の正極に戻っていきます。そのため、陰極は電子を受け取ります。よって陰極では還元反応が起きます。また、陽極は電子を放出するので、陽極では酸化反応が起きます。
今回の例でいえば、陰極では銅イオンが還元されて銅となり、陽極では銅が酸化されて銅イオンとなります。
陰極:Cu2+ + 2e- → Cu
陽極:Cu → Cu2+ + 2e-
このように電池によって電子を移動させ、酸化還元反応を引き起こすのが電気分解なのです。
電気分解における陰極と陽極の反応の順番
それでは次に、電気分解の反応の順番を確認します。
電気分解において陰極と陽極で起きる反応には、反応の起きやすさの順番にルールがあります。このルールは必ず頭に入れましょう。これを知らないと電気分解の問題はまったく解けません。
電気分解における陰極の反応
それでは陰極の反応から確認していきます。

陰極では還元反応が起きているので還元されやすい順に反応が起きます。
ⅰ)まずは水溶液中に銀イオンや銅イオンがある場合は、それらが還元されて銀や銅が析出します。もう少し正確にいうと、水素よりもイオン化傾向が小さい金属のイオンが水溶液中にある場合は、それが還元されます。
なぜならイオン化傾向が小さいということは還元されやすいということなので、水素の発生よりも優先して還元反応が起きるからです。
ⅱ)次に水溶液中に銀イオンや銅イオンがなく、水溶液が酸性の場合、水素イオンが還元されて水素が発生します。水溶液が酸性であれば、水素イオンはたくさんあるので、この反応が起きます。
ⅲ)そして最後に水溶液中に銀イオンや銅イオンがなく、さらに水溶液が酸性でもないときは水が還元されて水素と水酸化物イオンが生成します。
水の反応は最後に起きるということは覚えておきましょう。そもそも水は酸化還元反応がしやすい物質ではないので、その他の条件が満たされていないときに、やっと反応するのです。
また水素よりもイオン化傾向が大きい金属は析出することが基本的にありません。なぜならイオン化傾向が大きいということは還元されにくいということなので、水素が発生する状況であれば、水素よりもイオン化傾向の大きい金属は還元されず、水素の発生が優先されるからです。
さらに、3番目の反応が起きたときは水酸化物イオンが出るということにも注意しましょう。つまり、この反応が起きた後は水溶液は塩基性になります。
電気分解における陽極の反応
続いて陽極の反応を確認します。

陽極では酸化反応が起きます。そのため酸化されやすい順で反応が起きます。陽極の場合はまず電極を確認しましょう。
ⅰ)電極が金属の場合は、その金属電極が溶解します。例えば陽極の電極が銅の場合は、銅は酸化されて銅イオンとなり、水溶液に溶け出します。
この金属というのをもう少し正確にいうと、プラチナや金よりもイオン化傾向が大きい金属のことです。プラチナや金は電気分解でも酸化させることができないので、これらを電極に使っても溶解することはありません。
ⅱ)続いて電極がプラチナや炭素、つまり電気分解によって溶解しない電極を使った場合は、水溶液に着目します。まず水溶液中にハロゲンのイオンがある場合は、それらが酸化されてハロゲンが発生します。
例えば塩化物イオンがある場合は、塩化物イオンが酸化されて塩素が発生し、臭化物イオンがある場合はそれが酸化されて臭素が発生します。
ⅲ)さらに電極がプラチナや炭素で、水溶液が塩基性の場合は水酸化物イオンが酸化されて酸素が発生します。
ⅳ)そして、陽極もこれらの条件をすべて満たさなかった場合は水が反応します。水が酸化されて酸素と水素イオンが発生します。
陰極も陽極も水が反応するのは最後であるということは覚えておきましょう。
また陰極で水が反応した場合は、水酸化物イオンが発生して、塩基性になるのに対して、陽極で水が反応した場合は、水素イオンが発生して、酸性になります。
これが電気分解の反応の順番です。必ず自分でできるようになるまで復習するようにしてください。
電気分解における計算の方程式の立て方
それでは次に、電気分解の計算における方程式の立て方について解説します。
電気分解の計算をするときは下図の関係を使って方程式を立てます。

上の3つは電池の方程式を表しています。電気分解は電池の負極と正極に電極をつないで行うので、電池の式にそのままつながっていきます。
この1番上の式を簡単に確認しておきます。「I」は電流で単位はA(アンペア)です。「t」は時間で単位はs(秒)です。そして電流と時間をかけることで電気量、単位はC(クーロン)になります。この回路に流れた電気量をファラデー定数、つまり9.65×104[C/mol]で割ることで、回路に流れた電子の物質量となります。
そして全ての電極はつながっているので、どの電極であっても流れている電子の物質量は変わらないため、この方程式が成り立つのです。
それではこの関係を使って実際に問題を解いてみましょう。
例題①:陽極で発生した気体の体積
それでは問題を解いていきます。なお今回扱う問題は、すべて有効数字は2桁で答えます。まずはこの問題を解きます。
硫酸銅水溶液を両極とも白金板で電気分解したところ、陰極に銅が0.384g 析出した。そのとき陽極から発生した気体の体積は標準状態で何Lか求めてみましょう。ただし銅の原子量は64とします。
陰極と陽極の反応の確認
それではまず陰極と陽極でどのような反応が起きているのかを考えていきます。
そのためにも簡単に図をかいて、電子の流れを確認しましょう。
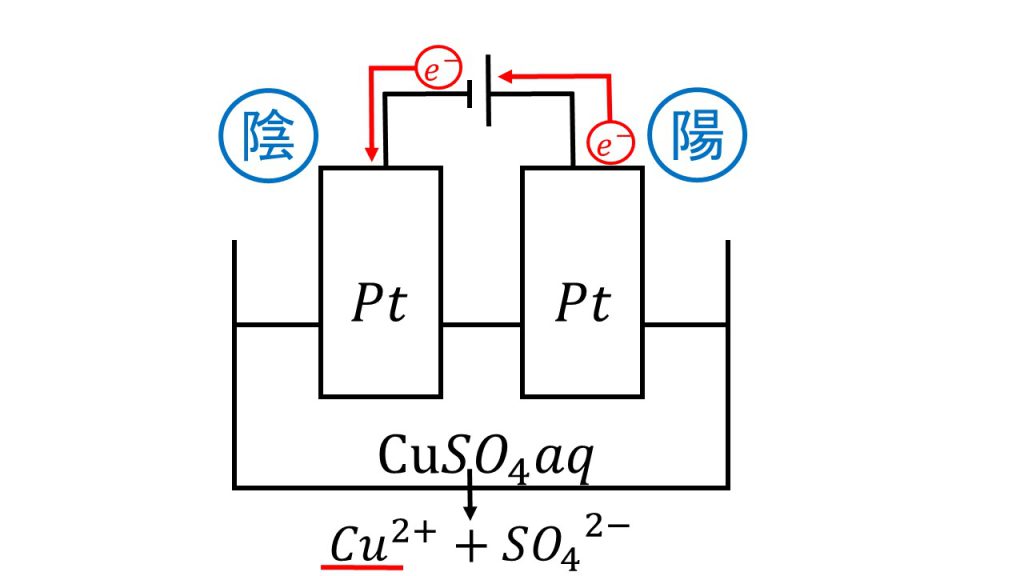
電子は負極から出て陰極に入り、陽極から出て正極に戻ります。このように電池や電気分解の問題を考えるときは、電子の流れる向きを確認するようにしましょう。
これで陰極では還元反応が起き、陽極では酸化反応が起きているということが確認できたので、先ほど解説した酸化還元反応の反応の順番で陰極と陽極の反応を考えていきます。
陰極ですが、陰極はまず水溶液を見て銀イオンか銅イオンがないか確認します。今回は水溶液が硫酸銅水溶液なので、水溶液中には銅イオンが存在します。そのため陰極では銅イオンが還元されて、銅が析出しています。
陰極:Cu2+ + 2e- → Cu
次に陽極ですが、陽極はまず電極を見ます。今回電極は白金なので電極が酸化されることはありません。電極が白金のときは水溶液を見ます。水溶液にハロゲン化物イオンがあるかどうかを確認してみると、今回はありません。次に水溶液が塩基性かどうかを確認します。今回は硫酸銅水溶液なので塩基性ではありません。したがって今回反応しているのは、順番では一番最後の水となり、陽極では以下の反応が起きています。
陽極:2H2O → O2 + 4H+ + 4e-
これで陰極と陽極の反応が分かったので、今回求める気体の体積というのは、酸素の体積ということになります。
方程式を立てる
それでは方程式を立てていきます。
求める酸素の体積をV[L]とすると、今回問題文で情報が与えられているのは、陰極と陽極だけなので、「陰極が受け取る電子の物質量=陽極が放出する電子の物質量」の方程式を作ります。

まずは析出した銅の質量0.384g を銅のモル質量で割ることで、析出した銅の物質量となります。そして、陰極の反応式を見ると銅と電子の係数の比が1:2なので×2をすることで、陰極が受け取った電子の物質量となります。
続いて発生した酸素の体積を標準状態なので22.4[L/mol]で割ることで、陽極で発生した酸素の物質量となります。そして、陽極の反応式を見ると酸素と電子の係数の比が1:4なので×4をすることで電子の物質量となります。
そして、陰極でも陽極でも流れている電子の量は変わらないので、方程式が成り立ちます。
工夫しながら計算する
あとはこの方程式を解いていきます。
求めたい文字だけを左辺にして残りを右辺に集めます。そして小数点が計算しにくいので、小数点を外に出します。あとは約分できるだけ約分をして、かけ算をして有効数字2桁になるように四捨五入したら、答えは6.7×10-4 Lとなります。
いかがでしょうか。これが電気分解の計算の基本の流れとなります。
例題②:電気量を使った計算
それでは次は、この問題を解いてみます。
塩化銅水溶液に白金板の電極を入れ、0.50Aの電流を32分10秒流した。では発生した気体は27℃、1.0×105 Pa で何Lか求めてみましょう。
陰極と陽極の反応
先ほどと同様に簡単に図をかき、電子の流れを確認した上で、陰極と陽極の反応を考えていきます。
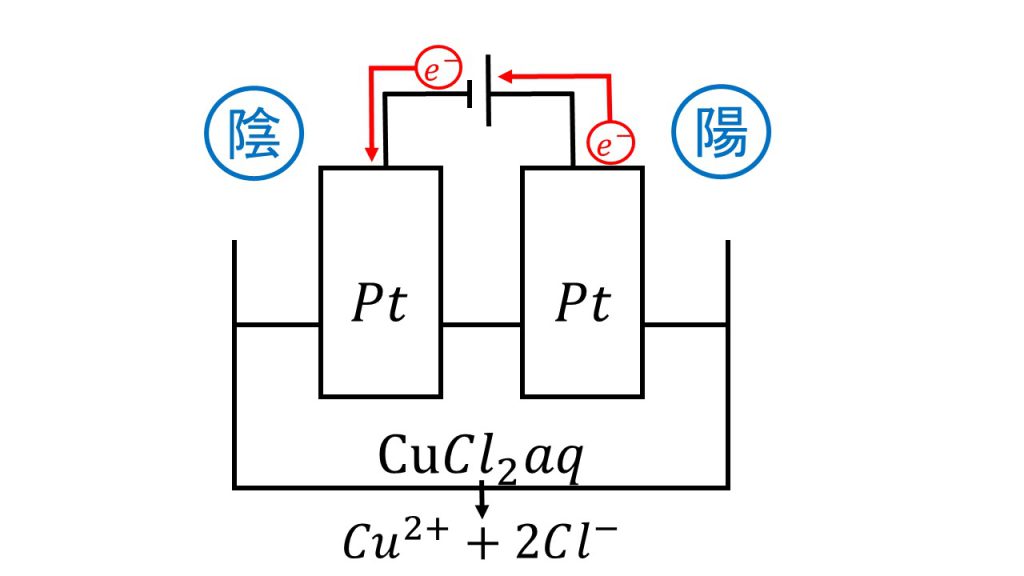
まず陰極ですが、水溶液を見て銀イオンか銅イオンがないか確認します。今回は塩化銅が電離して銅イオンがあるので、銅イオンが還元されて銅となります。
陰極:Cu2+ + 2e- → Cu
次に陽極ですが、まずは電極を見ます。電極は白金なので、次に水溶液を見ます。水溶液にハロゲン化物イオンがあるかどうかを確認してみると、今回は塩化銅が電離して塩化物イオンがあるので、陽極では塩化物イオンが酸化されて塩素となります。よって今回発生した気体というのが塩素のことです。
陽極:2Cl- → Cl2 + 2e-
方程式を立てる
それでは反応が確認できたので、方程式を立てて問題を解いていきます。
今回は流した電流の大きさとその時間、そして陽極で発生した気体、この2つの情報があるので、それらを使って方程式を立てます。

まずは求める気体の体積をV[L]として、左辺は流した電気量から電子の物質量を求めます。電流のアンペアに、流した時間を秒にしてかけて、電気量つまりクーロンとします。それをファラデー定数である9.65×104[C/mol]で割ることで、流した電子の物質量となります。
次に、右辺はまず塩素の物質量を求めるのですが、今回は標準状態ではないので、状態方程式を使って塩素の物質量を求めます。つまりpV=nRTより、n=PV/RTとなるので、今回発生した塩素の物質量は1.0×105[Pa]×V[L]/8.3×103×(27+273)[K]となります。そして陽極の反応式を見ると、塩素と電子の係数の比が1:2なので、×2をすることで電子の物質量となります。
これで方程式ができました。
今回は計算を省略して答えは0.12Lとなります。
気体の体積を答えるときは、標準状態なのかそうでないのかはよく注意しておきましょう。もちろん標準状態でないときは22.4[L/mol]は使えません。
いかがだったでしょうか。今回解説した考え方を使えば電気分解の問題は確実に解けるようになります。ぜひ復習しておいてください。
- 電気分解の応用問題→電気分解における水溶液の濃度変化の問題
(3)解説授業の内容を復習しよう
(4)電気分解の解説一覧
①電気分解の計算の基本(電気分解における陰極と陽極での反応の順番のルールについても解説しています)
②電気分解における陰極と陽極の反応の順番ルール(「電気分解の計算の基本」から切り抜いています)
④アルミニウムの溶融塩電解(そもそも溶融塩電解とは何か、なぜ水を使ってはいけないのか、氷晶石、クラーク数などについても解説しています)
⑤「銅の電解精錬」完全解説(黄銅鉱から粗銅への製錬、粗銅が陽極で純銅が陰極の理由、不純物の酸化、陽極泥、計算問題の考え方、銅の電解精錬特有の式の立て方についても解説しています)
(5)参考
☆電池と電気分解(理論化学)の解説・授業・知識・演習問題一覧
☆化学の解説動画・授業動画一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識テスト一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学の解説・授業・知識・演習問題一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学の語呂合わせ(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
「化学計算の王道」シリーズは『思考訓練の場としての体系化学』(GHS予備校)を参考にしています。
GHS予備校についてはこちら→https://ghs-yobikou.co.jp/
思考訓練シリーズの購入はこちら→https://ghs-yobikou.shop/
