(1)解説授業動画
☆YouTubeチャンネルの登録をよろしくお願いします→大学受験の王道チャンネル
(2)解説授業の原稿
入試問題では電池や電気分解の問題は、最後に電解液や水溶液の濃度変化を聞かれることが多いです。そのため電池や電気分解の問題でしっかりと点を取りたいのであれば、このタイプの問題はマスターしておきましょう。
それでは早速問題を解きながら解説していきます。なお今回は、電気分解の基本的な考え方は理解できている前提で話を進めていきます。もし理解が不十分な場合はまずそちらの解説を確認するようにしてください。
例題
それでは問題を確認します。
0.5mol/Lの塩化銅水溶液250mLを取り、白金板を電極として、0.5Aの電流を32分10秒流した。塩化銅水溶液の濃度は何mol/Lとなったか求めてみましょう。
陰極と陽極の反応の確認
まずは陰極と陽極の反応を確認します。簡単に図をかき、電子の流れを確認して、陰極は還元されて、陽極は酸化されることを確認します。
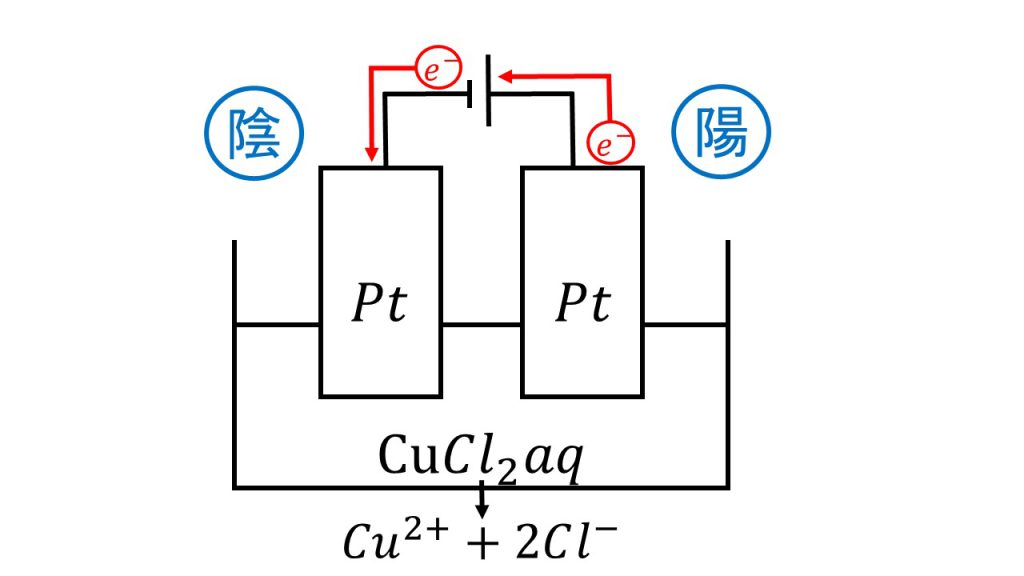
そして電気分解の順番通りに考えていきます。陰極では水溶液に銅イオンがあるので、銅イオンが還元されて銅が析出します。
Cu2++2e– → Cu
陽極は電極がPtで、水溶液にハロゲン化物イオンである塩化物イオンがあるので、塩化物イオンが酸化されて塩素となります。
2Cl– → Cl2+2e–
ここまでは電気分解の基本通りの流れとなります。そして、ここからが水溶液の濃度変化を考える問題の流れとなります。
電気分解全体の反応式を考える
まずは電気分解全体の化学反応式を考えます。
陰極と陽極の式を足し合わせることで、電気分解全体の化学反応式ができます。左辺は銅イオンと2つの塩化物イオンがくっついて塩化銅となり、電子は両辺に同じ数だけあるので足すことで消えます。そして、銅と塩素が右辺になります。
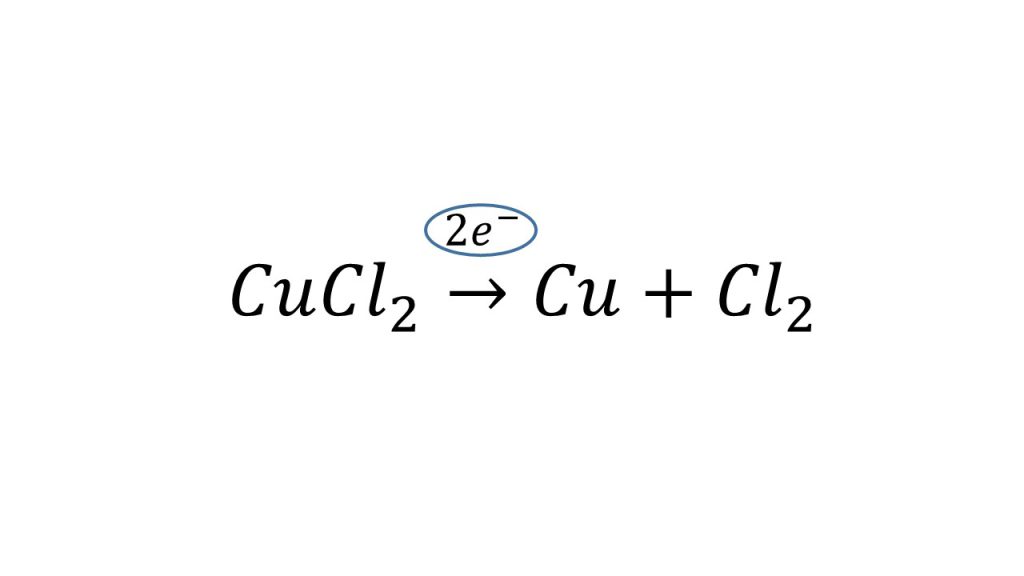
これが今回の電気分解全体の化学反応式となります。
つまり今回の電気分解は全体として見ると、塩化銅を銅と塩素に分解する反応であったということになります。
ではなぜ全体の化学反応式を作る必要があるのかというと、半反応式は陰極と陽極それぞれで起きている反応ですが、陰極と陽極はどちらも同じ水溶液に浸かっています。つまり、これらの反応は水溶液においては同時に起きているので、水溶液を考える問題の場合は、これらの式を合わせた式を用意した方が考えやすくなるからです。
また全体で式を書くときに注意したいポイントは、矢印の上にこの反応が起きたときに移動した電子の数を書いておくということです。これは後で計算で使うので、忘れずに書いておきましょう。
ちなみに今回なぜ2なのかというと、1molの銅を析出するのに2molの電子が必要であり、1molの塩素が発生するときは2molの電子が放出される、つまり1molの塩化銅が、1molの銅と1molの塩素に分解するとき、この回路では2molの電子が移動したことになるので、今回電子の係数は2となります。もう少し簡単に言うと、この2つの式を足し合わせて全体の式を作るときに消去したときの電子の係数がここにきます。
電気分解後の塩化銅水溶液のモル濃度の式を立てる
それでは全体の化学反応式が出来たので、電気分解後の塩化銅水溶液のモル濃度を求めていきます。
以下が電気分解後の水溶液のモル濃度の式となります。濃度の計算なので、1つずつ溶質なのか溶媒なのか溶液なのか考えながら確認していきましょう。

モル濃度なので、分母は溶液のLとなります。今回は溶液の体積が250mLなので、それを10-3倍することで溶液のLとします。ただし基本的に問題文に書いていない限り、溶液の体積は電気分解の前と後で変化しないものとして考えます。
そして次に分子を考えます。分子は溶質の物質量となります。ポイントは電気分解によって濃度が変化しているので、電気分解前の溶質の物質量から、電気分解によって変化した溶質の物質量を足したり引いたりして、電気分解後の溶質の物質量とします。今回マイナスにしているのは、溶質である塩化銅は電気分解によって分解しており、それはつまり溶質である塩化銅の量が減っているということなのでマイナスとします。
それでは分子の式を確認していきます。変化前の溶液のモル濃度に、溶液の体積をかけることで、変化前の溶質の物質量となります。次に、今回流した電流のアンペアに電流を流した秒数をかけることで電気量、つまりクーロンとなり、それをファラデー定数で割ることで流した電子の物質量となります。そして全体の反応式を見ると、電子が2mol流れたとき、塩化銅は1mol分解するので、×1/2をすることで、今回の電気分解で分解した溶質である塩化銅の物質量となります。そして電気分解前の溶質の物質量から、分解した溶質の物質量を引くことで、電気分解後の溶質の物質量となります。
工夫しながら計算する
これで式が出来たので後はこの式を計算していきます。まずはこの電子の物質量の部分だけ先に計算します。
-1024x576.jpg)
カッコの中から10を括り出し、小数点が面倒なので、104から10を2つ使って小数点を2つ動かします。そして0.5×10が5となって、かっこの中の計算をすると193となり965は193で割り切れるので、約分をして、さらに約分をすると、結局電子の物質量は10-2となります。
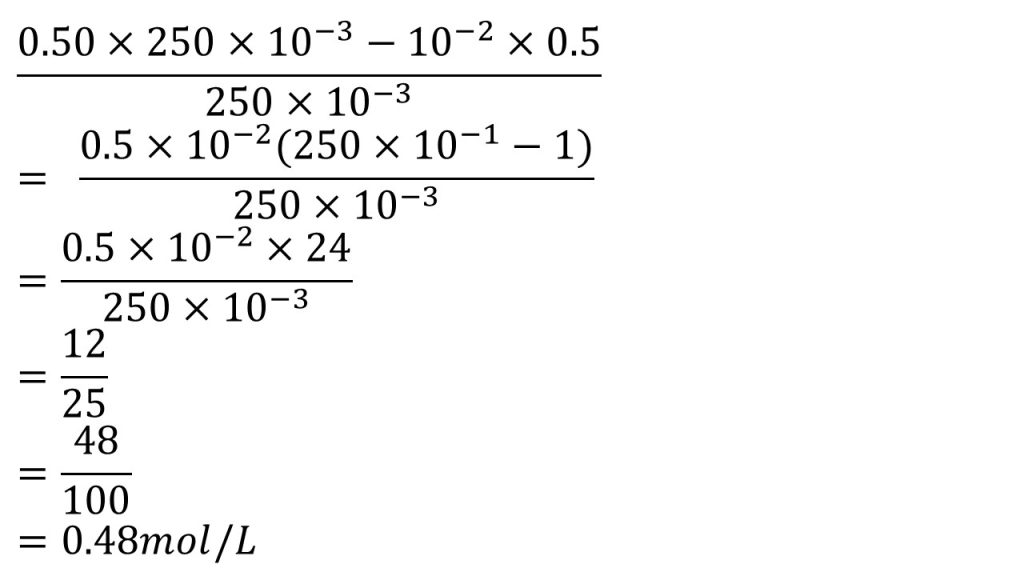
また1/2は0.5としておきます。すると分子が0.5と10-2で因数分解でき、250×10-1と-1が残ります。そして0.5の小数点を1つ動かし5×10-3とし、かっこの中を計算すると25-1=24となります。
後は約分をして24/50となり、これをそのまま割り算してもいいのですが、少しテクニックとして、分母が10や100などに簡単に出来るときは、分母を10や100にすると暗算で解くことが出来るようになります。今回では分母と分子を2倍すると48/100となり、答えは0.48mol/Lとなります。
このように化学の計算をする時はなるべく工夫をして正確にかつ楽に計算できるようにしましょう。
いかがだったでしょうか。電気分解における水溶液の濃度変化の問題の解法の流れが理解できたでしょうか。電池や電気分解の問題を得点源にしたい方はぜひ復習するようにしてください。
(3)解説授業の内容を復習しよう
(4)電気分解の解説一覧
①電気分解の計算の基本(電気分解における陰極と陽極での反応の順番のルールについても解説しています)
②電気分解における陰極と陽極の反応の順番ルール(「電気分解の計算の基本」から切り抜いています)
④アルミニウムの溶融塩電解(そもそも溶融塩電解とは何か、なぜ水を使ってはいけないのか、氷晶石、クラーク数などについても解説しています)
⑤「銅の電解精錬」完全解説(黄銅鉱から粗銅への製錬、粗銅が陽極で純銅が陰極の理由、不純物の酸化、陽極泥、計算問題の考え方、銅の電解精錬特有の式の立て方についても解説しています)
(5)参考
☆電池と電気分解(理論化学)の解説・授業・知識・演習問題一覧
☆化学の解説動画・授業動画一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識テスト一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学の解説・授業・知識・演習問題一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学の語呂合わせ(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
「化学計算の王道」シリーズは『思考訓練の場としての体系化学』(GHS予備校)を参考にしています。
GHS予備校についてはこちら→https://ghs-yobikou.co.jp/
思考訓練シリーズの購入はこちら→https://ghs-yobikou.shop/
