(1)解説授業動画
☆YouTubeチャンネルの登録をよろしくお願いします→大学受験の王道チャンネル
(2)解説授業の原稿
銅の電解精錬とは
今回は銅の電解精錬について解説します。
銅の電解精錬とは下図のように、不純物を含む銅である粗銅を電気分解して、粗銅から銅イオンを取り出し、その銅イオンを還元させることで、純銅を得る方法のことです。
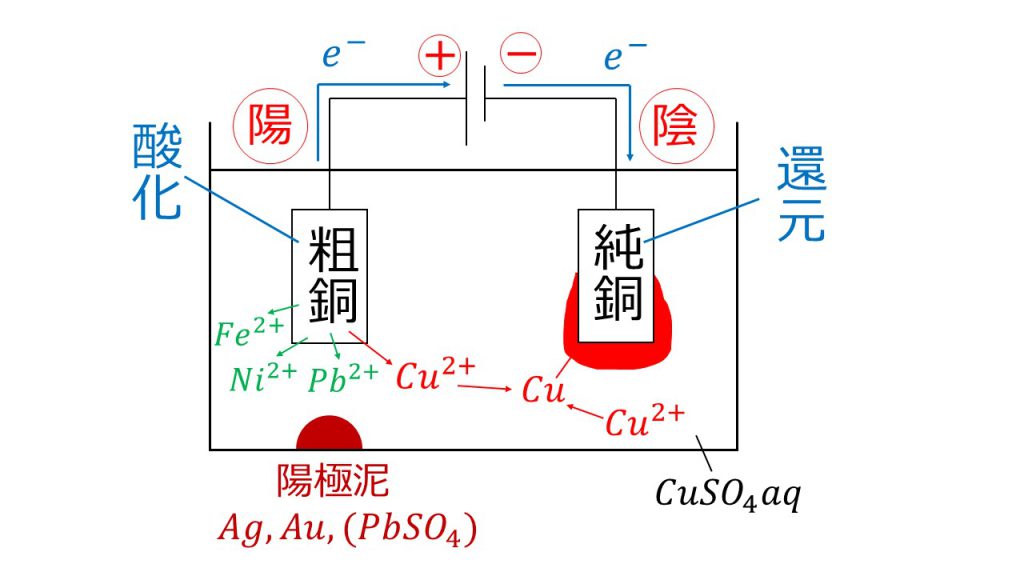
黄銅鉱から単体の銅を得るまでの流れ
今回は、この銅の電解精錬の原理と注意点を解説しますが、その前にまず、銅の鉱石である黄銅鉱から単体の銅を得るまでの流れを簡単に確認します。
まず、銅の主要な鉱石は黄銅鉱(おうどうこう)で、化学式はCuFeS2となります。
そして、この黄銅鉱をコークス(石炭から得られる炭素を多く含む物質)、石灰石、酸素とともに約1300℃で強熱します。すると、硫化銅(Ⅰ)Cu2Sが生成します。ちなみに、コークスとは炭素のことで、石灰石とは炭酸カルシウムCaCO3のことです。
そして、さらに硫化銅(Ⅰ)Cu2Sに酸素を吹き込むと単体の銅が得られます。ただ、ここで得られる銅は、純度が約99%の(不純物を約1%含む)銅なので、「粗銅」と呼ばれています。
この粗銅の状態では製品として使えないので、この粗銅から純銅(純度約99.99%)を得る必要があります。その粗銅から純銅を得る方法が銅の電解精錬なのです。
銅の電解精錬の仕組み
それでは、銅の電解精錬の仕組みを解説します。
銅の電解精錬とは、粗銅と純銅を硫酸銅(Ⅱ)水溶液CuSO4aqに漬けながら行う電気分解のことです。(aqとはaquaの略で、水溶液であることを意味します。)
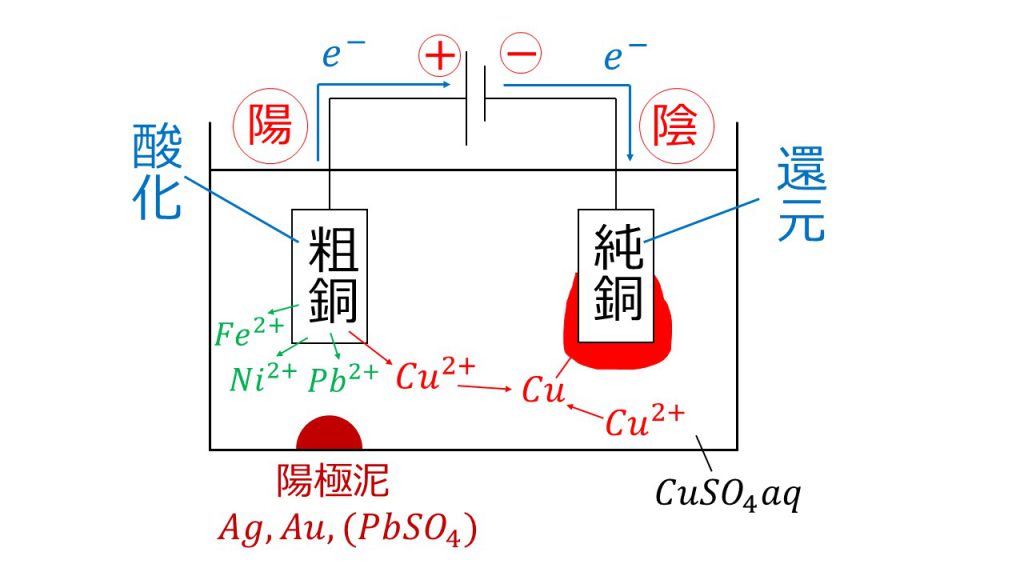
粗銅と純銅のどちらを陽極・陰極にするか
ここでまずポイントとなるのが、粗銅と純銅のどちらを陽極にして、どちらを陰極にするかということです。この陽極か陰極かは理屈で考えるようにしましょう。
そもそも銅の電解精錬は、粗銅から銅を溶かし出して、純銅に銅を析出させるために行います。そのため、粗銅では酸化反応が、純銅では還元反応が起きていないといけません。
そして、「酸化される」ということは「電子を放出する」ということであり、「還元される」ということは「電子を受け取る」ということなので、電子の流れが粗銅→純銅の向きになっていないといけません。
さらに、電池は正極で電子を受け取り、負極から電子を放出するので、電池の正極と負極の向きは、粗銅側が正極で、純銅側が負極になっていないといけません。
よって、正極側につなぐ電極のことを陽極といい、負極側につなぐ電極のことを陰極というので、粗銅が陽極で、純銅が陰極になるのです。
このように、粗銅と純銅が陽極なのか陰極なのかは、電子の流れを考えて理解するようにしましょう。
陽極と陰極での反応
このように、粗銅を陽極、純銅を陰極として電気分解をすると、陽極と陰極でそれぞれ以下のような反応がおきます。
陽極:Cu → Cu2+ + 2e-
陰極:Cu2+ + 2e- → Cu
※陽極では銅以外の金属の酸化も起きている。(後ほど解説)
陽極では銅が酸化されて銅イオンとなり、陰極では銅イオンが還元されて銅となります。つまり、陽極である粗銅から銅イオンが溶け出して、陰極である純銅に銅が析出します。これを繰り返していくのが、銅の電解精錬なのです。
陽極での反応の注意点:粗銅に含まれる不純物はどうなるのか
それでは、銅の電解精錬の基本的な仕組みが理解できたと思うので、次は陽極と陰極の反応における注意点を確認します。

まずは、陽極での反応の注意点を確認します。
陽極である粗銅には、不純物として、鉄Fe、ニッケルNi、鉛Pb、銀Ag、金Auなどの金属が含まれています。これらの不純物の金属がどうなるか考えてみましょう。ポイントは、不純物の金属を2つのグループに分けることです。どのように分けるのかというと、①銅よりもイオン化傾向が大きいグループと、②銅よりもイオン化傾向が小さいグループに分けます。
①銅よりもイオン化傾向が大きい不純物
銅よりもイオン化傾向が大きい金属は、酸化されてイオンとなった後、水溶液中を還元されることなく漂います。なぜなら、銅よりもイオン化傾向が大きいということは、銅よりも酸化されやすく還元されにくいからです。
つまり、銅よりも酸化されやすいので、陽極では銅よりも先に酸化されてイオンとなります。しかし、銅よりも還元されにくいので、陰極で銅イオンより先に還元されることはありません。そのため、これらの金属は、一度イオンとなったら、そのまま水溶液中を漂うことになるのです。
②銅よりもイオン化傾向が小さい不純物
また、銅よりもイオン化傾向が小さい金属は、そもそも酸化されません。そのため、粗銅に含まれている銀や金は、粗銅の酸化が進むにつれて、そのまま陽極の下にたまっていきます。
この銀や金などが陽極の下にたまったものを陽極泥(ようきょくでい)と言います。注意点としては、銀や金は酸化されていないので、イオンではないことに注意しましょう。
ちなみに、厳密なことを言うと、鉛イオンは水溶液中の硫酸イオンと反応して、硫酸鉛となります。硫酸鉛は水に溶けにくい性質があるため、陽極泥に含まれることになります。
また、陽極泥の銀や金は貴重な金属なので、分離して回収します。
陰極での反応の注意点:硫酸銅(Ⅱ)から電離した銅イオンも還元される
次に、陰極での反応の注意点ですが、陰極で析出する銅には、粗銅から溶け出した銅イオンが還元されたものだけでなく、硫酸銅(Ⅱ)から電離した銅イオン(水溶液中に存在)が還元されたものもあるということにも注意しましょう。
以上が、銅の電解精錬において知っておきたい知識です。
銅の電解精錬特有な式の立て方
それでは最後に、銅の電解精錬の計算問題の注意点を確認します。
難しめの入試問題で、銅の電解精錬の計算問題が出題されることがあります。基本的には電気分解の計算の流れで解いていくのですが、銅の電解精錬特有の式の立て方をすることがあるので注意が必要です。
今回は3つの特有な式の立て方を紹介します。
①陽極の質量の減少量による立式
まず1つ目は、
陽極の質量の減少量〔g〕
=粗銅から銅イオンとなって溶け出した銅の質量〔g〕
+イオンとなって溶け出した不純物(鉄、ニッケル、鉛など)の質量〔g〕
+イオンとはならずに陽極泥にたまる銀や金の質量〔g〕
この関係式が成り立ちます。
注意したいのは、「陽極での減少量は、銅だけではない」ということです。粗銅には銅以外の金属が含まれているので、粗銅の減少量は、水溶液あるいは陽極泥に移動した金属すべての量の合計となるということです。
②陰極の質量の増加量による立式
2つ目の独特な式の立て方は、以下の通りです。
陰極の質量の増加量〔g〕
=粗銅から溶け出した銅イオンが還元されてできた銅の質量〔g〕
+硫酸銅(Ⅱ)から電離した銅イオン(水溶液中に存在)が還元されてできた銅の質量〔g〕
銅の電解精錬において、陰極に析出する銅は、すべてが粗銅から溶け出した銅イオンが還元されてできたものではありません。硫酸銅(Ⅱ)から電離した銅イオン(水溶液中に存在)が還元されてできた銅も含まれているのです。
そのため、この式が成り立つわけですが、硫酸銅(Ⅱ)から電離した銅イオン(水溶液中に存在)が還元されて銅となると、水溶液の濃度変化を伴うので注意が必要です。
つまり、硫酸銅(Ⅱ)水溶液の濃度計算をしたり、濃度の減少量から硫酸銅(Ⅱ)から電離した銅イオン(水溶液中に存在)が還元されてできた銅の質量を計算したりすることがあるので注意が必要です。
③回路に流れた電子の物質量による立式
それでは、3つ目の特有な式の立て方を確認します。
電源が流す電子の物質量〔mol〕
=粗銅から溶け出した銅(銅イオン)の物質量×2〔mol〕
+粗銅からイオンとなって溶け出す不純物が酸化されたときに放出する電子の物質量(鉄イオンの物質量×2+ニッケルイオンの物質量×2+鉛イオンの物質量×2)〔mol〕
=粗銅から溶け出した銅イオンの物質量×2〔mol〕
+硫酸銅(Ⅱ)から電離した銅イオン(水溶液中に存在)が還元されてできた銅の物質量×2〔mol〕
この等式が成り立ちます。
この等式は、電池や電気分解の計算の基本である「回路のどの場所であっても、流れる電子の物質量は変わらない」という原則を表しています。
電源が流す電子の物質量の求め方
まず、電源が流す電子の物質量は、Q=It(C:電気量〔C〕、I:電流〔A〕、t:時間〔s〕)で電気量を求め、その電気量をファラデー定数(9.65×104〔C/mol〕)で割ることで求めることができます。(ファラデー定数(9.65×104〔C/mol〕)は電子1molの電気量を表しています。)
この式の詳しい使い方については、電池や電気分解の計算の基本の解説をご覧になってください。
陽極で放出される電子の物質量
次に、
=粗銅から溶け出した銅(銅イオン)の物質量×2〔mol〕
+粗銅からイオンとなって溶け出す不純物が酸化されたときに放出する電子の物質量(鉄イオンの物質量×2+ニッケルイオンの物質量×2+鉛イオンの物質量×2)〔mol〕
この部分についてですが、陽極において酸化されているのは銅イオンだけでなく、銅よりもイオン化傾向が大きい金属も酸化されて電子を放出しているので、この等式を成り立たせるためには、銅が放出した電子の物質量だけでなく、イオンとなった不純物が出した電子の物質量も加えないといけません。
ちなみに、銅のように酸化されて2価の陽イオンとなる場合(Cu → Cu2+ + 2e-)は、陽極での反応式の電子の係数が2となるので、×2をすることで電子の物質量となります。
陰極が受け取った電子の物質量
次に、
=粗銅から溶け出した銅イオンの物質量×2〔mol〕
+硫酸銅(Ⅱ)から電離した銅イオン(水溶液中に存在)が還元されてできた銅の物質量×2〔mol〕
この部分ですが、こちらは陰極での還元反応で受け取った電子の物質量を表しています。
先程も確認した通り、陰極で析出する銅は、粗銅から溶け出した銅イオンが還元されたものだけではなく、硫酸銅(Ⅱ)から電離した銅イオン(水溶液中に存在)が還元されたものも含みます。
そのため、等式を成り立たせるためには、粗銅から溶け出した銅イオンが還元されたときに受け取った電子の物質量に、硫酸銅(Ⅱ)から電離した銅イオン(水溶液中に存在)が還元されたときに受け取った電子の物質量を加えないといけません。
ちなみに、銅イオンは2価の陽イオンなので、陰極での反応式(Cu2+ + 2e- → Cu)において受け取る電子の係数が2となるため、銅イオンの物質量を2倍することで、受け取った電子の物質量となります。
2つの式を比較して分かること
また、
粗銅から溶け出した銅(銅イオン)の物質量×2〔mol〕
+粗銅からイオンとなって溶け出す不純物が酸化されたときに放出する電子の物質量(鉄イオンの物質量×2+ニッケルイオンの物質量×2+鉛イオンの物質量×2)〔mol〕
=粗銅から溶け出した銅イオンの物質量×2〔mol〕
+硫酸銅(Ⅱ)から電離した銅イオン(水溶液中に存在)が還元されてできた銅の物質量×2〔mol〕
この2つの式を比べてみると分かるのですが、粗銅から溶け出した銅イオンが全て銅となって陰極に析出したと考えると、
粗銅からイオンとなって溶け出す不純物が酸化されたときに放出する電子の物質量(鉄イオンの物質量×2+ニッケルイオンの物質量×2+鉛イオンの物質量×2)〔mol〕
=硫酸銅(Ⅱ)から電離した銅イオン(水溶液中に存在)が還元されてできた銅の物質量×2〔mol〕
この関係が成り立つことが分かります。
つまり、イオンとなった不純物が放出した電子の物質量と、硫酸銅(Ⅱ)から電離した銅イオン(水溶液中に存在)が還元されて銅となったときに受け取った電子の物質量が等しくなるのです。
この関係を使うこともあるので注意しましょう。
いかがだったでしょうか。銅の電解精錬に関する知識は、ただ覚えるのではなく、理屈で理解しましょう。
(3)解説授業の内容を復習しよう
(4)工業的製法の解説授業一覧
①アルミニウムの溶融塩電解(そもそも溶融塩電解とは何か、なぜ水を使ってはいけないのか、氷晶石、クラーク数などについても解説しています)
②「鉄の製錬」完全解説(原料と生成物、製錬の過程(反応式)、石灰石の役割、還元の過程、四酸化三鉄についても解説しています)
③「銅の電解精錬」完全解説(黄銅鉱から粗銅への製錬、粗銅が陽極で純銅が陰極の理由、不純物の酸化、陽極泥、計算問題の考え方、銅の電解精錬特有の式の立て方についても解説しています)
④ハーバー・ボッシュ法の解説(なぜ高温高圧で行うのか、なぜ人類にとって重要なのか)
(5)電気分解の解説授業一覧
①電気分解の計算の基本(電気分解における陰極と陽極での反応の順番のルールについても解説しています)
②電気分解における陰極と陽極の反応の順番ルール(「電気分解の計算の基本」から切り抜いています)
(6)参考
☆化学の解説動画・授業動画一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識テスト一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学の解説・授業・知識・演習問題一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
