☆問題のみはこちら→気体の平衡の計算(問題)
☆解説授業①:化学平衡の基本(化学平衡とは何か、可逆反応・不可逆反応、グラフの読み取り、平衡定数の定義、化学平衡の法則・質量作用の法則)
☆解説授業②:平衡移動(ルシャトリエの原理)の解説(アルゴンを加える問題、二酸化窒素と四酸化二窒素の平衡の色の変化についても解説しています)
☆解説授業③:気体の平衡の計算(化学平衡の法則(平衡定数=一定)から方程式を立てる、平衡定数の求め方についても解説しています)
☆解説授業④:圧平衡定数の導出(濃度平衡定数・圧平衡定数とは何か、平衡定数の単位についても解説しています)
☆解説授業⑤:圧平衡定数の計算の解説(気体の平衡を考えるために必要なものについても解説しています)
☆解説授業⑥:ハーバー・ボッシュ法の解説(なぜ高温高圧で行うのか、なぜ人類にとって重要なのか)
※1atm=1.0×105Pa
①H2 + I2 ⇄ 2HI において、この反応は平衡状態にあるとする。この状態に関する次の記述a~eについて正しいものをすべて選べ。
a. H2とI2とが反応しなくなり、HIも分解しなくなった状態。
b. HIの生成速度と分解速度が等しくなった状態。
c. H2:I2:HIの体積比が、1:1:2になった状態。
d. それぞれの物質の濃度が一定になった状態。
e. 反応物質の分子数と生成物質の分子数とが等しくなった状態。

②448℃で、1.0Lの容器にH2とI2を0.5molずつ入れ、平衡状態H2 + I2 ⇄ 2HI に到達させたところ、HIが0.78mol存在していた。
1)反応が平衡に達するまでの、ヨウ化水素の見かけの増加速度はどうなるか。最も適当なものを選べ。
ア. 時間とともに増大する。
イ. 時間とともに減少する。
ウ. 時間に関係なく一定である。
エ. はじめ時間とともに減少するが、やがて一定になる。
オ. はじめ時間とともに減少するが、やがてゼロになる。
カ. はじめ増大するが、しばらくすると減少する。
キ. はじめ増大するがやがて一定になる。

2)このときの平衡定数を求めなさい。ただし、整数で答えよ。

3)次のうち、平衡定数が変化するのはどの場合か。
ア. H2を追加する。
イ. 圧力を上げる。
ウ. 温度を上げる。
エ. 触媒を加える。
答え:ウ
※触媒を加えたら反応速度は大きくなるが、正反応・逆反応ともに同じ割合で大きくなるので、平衡定数は変わらないことに注意。
4)448℃で、1.0Lの容器にH2を1.0mol、I2を2.0mol入れ、平衡状態に到達させたとき、HIが何mol存在するか。なお平衡定数を50として計算してよい。また、√41=6.4とし、有効数字2桁で答えよ。


③2.0molのSO2と1.0molのO2を混合すると、次の式により反応は進行し平衡に達する。
2SO2 + O2 ⇄ 2SO3
反応開始時の混合気体の全圧を1.0×105Paとして、温度と体積を一定にして反応させたところ、平衡時の全圧は0.8×105Paとなった。このときの反応の進行度α(平衡に達するまでに消費されたO2の量の、最初のO2の量に対する割合)の値を求めなさい。また、この反応の圧平衡定数Kpを有効数字2桁で求めなさい。



④窒素と水素を適当な条件下で反応させると次の反応によりアンモニアを生じる。
N2 + 3H2 ⇄ 2NH3
この反応は可逆反応であり、平衡状態におけるアンモニアの生成率は反応条件によってかなり異なる。下図は窒素と水素のモル比が1:3の混合気体を、600atmでいろいろ温度を変えて反応させ、平衡状態に達したときのアンモニアの体積百分率(%)を示している。
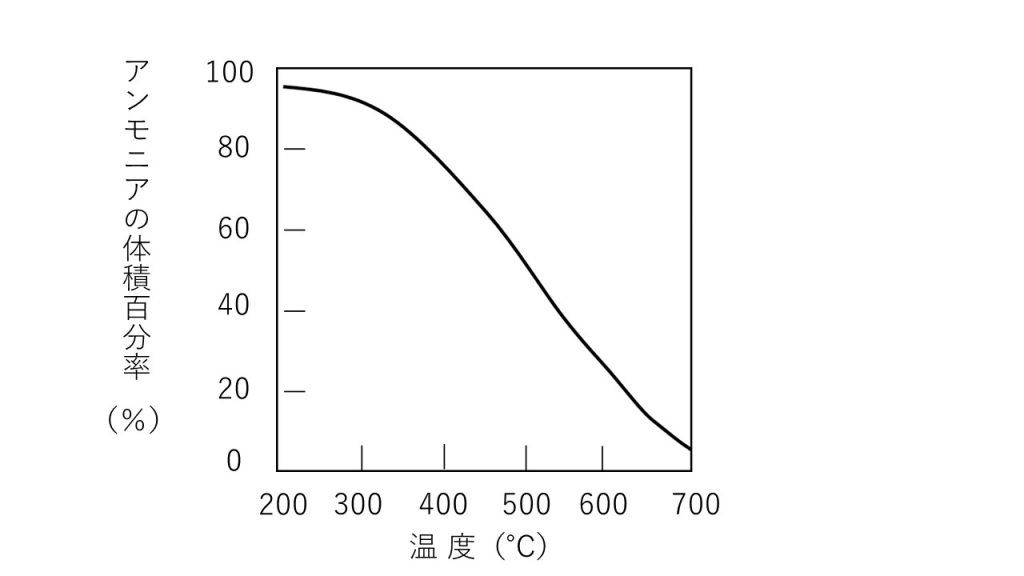
1)図に示した結果から、上記のアンモニアの生成反応は、発熱反応か、それとも吸熱反応か、理由とともに答えなさい。

2)体積VLの容器に、窒素1molと水素3molをとって反応させ、一定温度で平衡状態に達したとき、2x[mol]のアンモニアが生成したとする。この反応の濃度平衡定数をKcをVとxを用いて表せ。
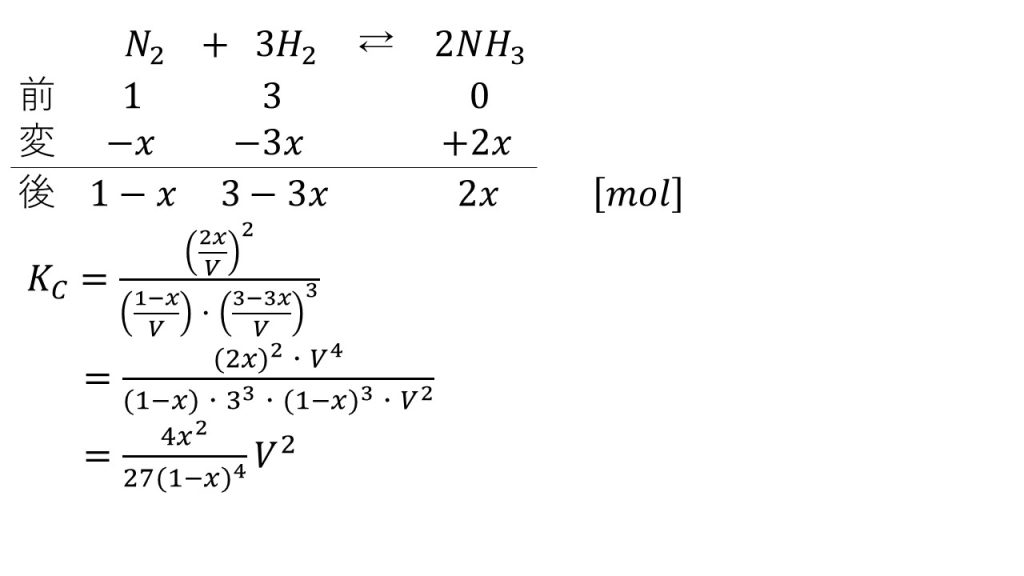
3)2)において、体積Vを大きくしたとき、上記の反応における平衡は左右いずれの方向に移動するか。Kcの式を用いて説明せよ。

⑤窒素と水素からアンモニアが生成する平衡反応N2 + 3H2 ⇄ 2NH3 に関して次の問いに答えよ。
1)N2とH2を1:3のモル比で混合した気体を、300~600℃の温度にして、鉄触媒の存在下で反応させたところ、平衡状態になった。この混合気体(100~600atm)に占めるNH3の体積百分率(%)は下図のようであった。次の記述のうち誤っているものはどれか。
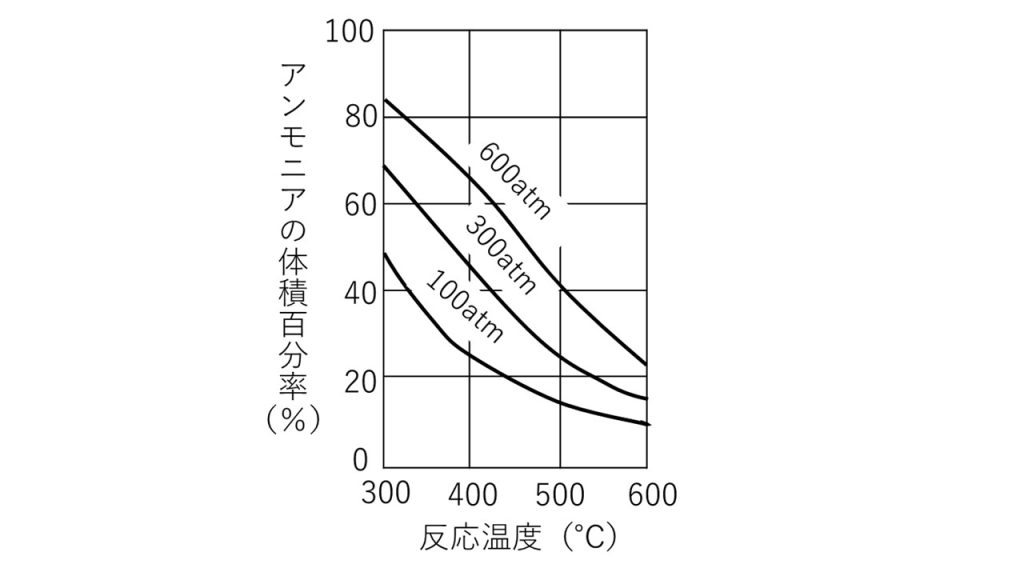
ア. 圧力一定で、温度が高いほどNH3の物質量は減る。
イ. 温度一定で、圧力が高いほどNH3の物質量は増える。
ウ. 温度・圧力一定で、鉄触媒の量を増やすとNH3の物質量は増える。
エ. 容器の体積と温度一定で、アルゴンを加えてもNH3の物質量は変わらない。
オ. 容器の体積と温度一定で、N250atmをさらに加えるとNH3の物質量は増える。

2)N220molとH260molとをある温度で反応させて平衡状態に達した。このとき、NH3が30mol生成し、全圧は600atmであった。反応温度として最も近いものはどれか。
ア. 300℃ イ. 340℃ ウ. 420℃ エ. 500℃ オ. 560℃ カ. 600℃

3)2)と同じ体積の容器に、NH3をa[mol]入れて、2)と同じ温度で反応を行ったところ平衡状態に達した。このとき生成したN2の物質量をx[mol]とするとき、aとxの関係式を求めなさい。


☆問題のみはこちら→気体の平衡の計算(問題)
【解説授業】
①化学平衡の基本(化学平衡とは何か、可逆反応・不可逆反応、グラフの読み取り、平衡定数の定義、化学平衡の法則・質量作用の法則)
②平衡移動(ルシャトリエの原理)の解説(アルゴンを加える問題、二酸化窒素と四酸化二窒素の平衡の色の変化についても解説しています)
③気体の平衡の計算(化学平衡の法則(平衡定数=一定)から方程式を立てる、平衡定数の求め方についても解説しています)
④圧平衡定数の導出(濃度平衡定数・圧平衡定数とは何か、平衡定数の単位についても解説しています)
⑤圧平衡定数の計算の解説(気体の平衡を考えるために必要なものについても解説しています)
⑥ハーバー・ボッシュ法の解説(なぜ高温高圧で行うのか、なぜ人類にとって重要なのか)
【その他参考となる解説】
①電離平衡の基本(弱酸・弱塩基の電離度とpHを求めます。近似についても解説しています)
②溶解平衡(溶解度積)の計算(溶解平衡とは何か、溶解度積=一定の導出、沈殿が生じるかどうかの判断の方法についても解説しています)
「化学計算の王道」シリーズは『思考訓練の場としての体系化学』(GHS予備校)を参考にしています。
GHS予備校についてはこちら→https://ghs-yobikou.co.jp/
思考訓練シリーズの購入はこちら→https://ghs-yobikou.shop/
~参考~
☆化学計算の王道(化学基礎・理論化学) ←その他の単元の計算問題と解説はこちら
☆化学の解説動画・授業動画一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識テスト一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学の解説・授業・知識・演習問題一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
