☆問題のみはこちら→溶解平衡(溶解度積)の計算(問題)
☆解説授業①:溶解平衡(溶解度積)の計算(溶解平衡とは何か、溶解度積=一定の導出、沈殿が生じるかどうかの判断の方法についても解説しています)
☆解説授業②:共通イオン効果を扱った問題の解説(共通イオン効果とは何か、図を使った問題の解説もしています)
※原子量:Ag=108, Cl=35.5
※有効数字は2桁で答えよ。
①ある温度での塩化銀の溶解度積は、[Ag+][Cl-]=8.1×10-11(mol/L)2である。
1)この温度では、塩化銀は水1.0Lに最大で何g溶けるか。

2)0.10mol/Lの硝酸銀水溶液100mLに0.10mol/Lの塩化ナトリウム水溶液を0.20mL加えたとき、塩化銀の沈殿が生じるか否かを判断せよ。
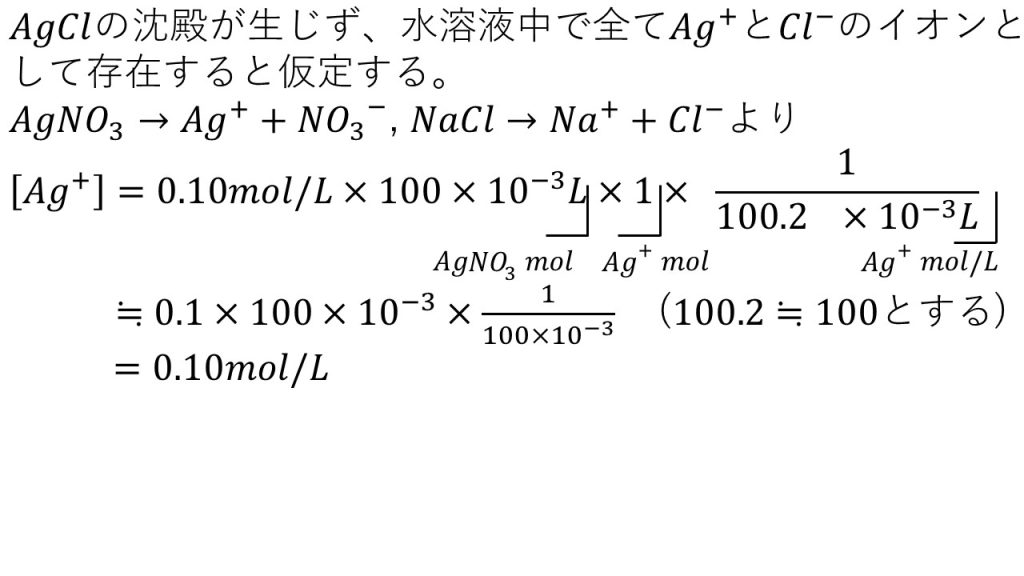
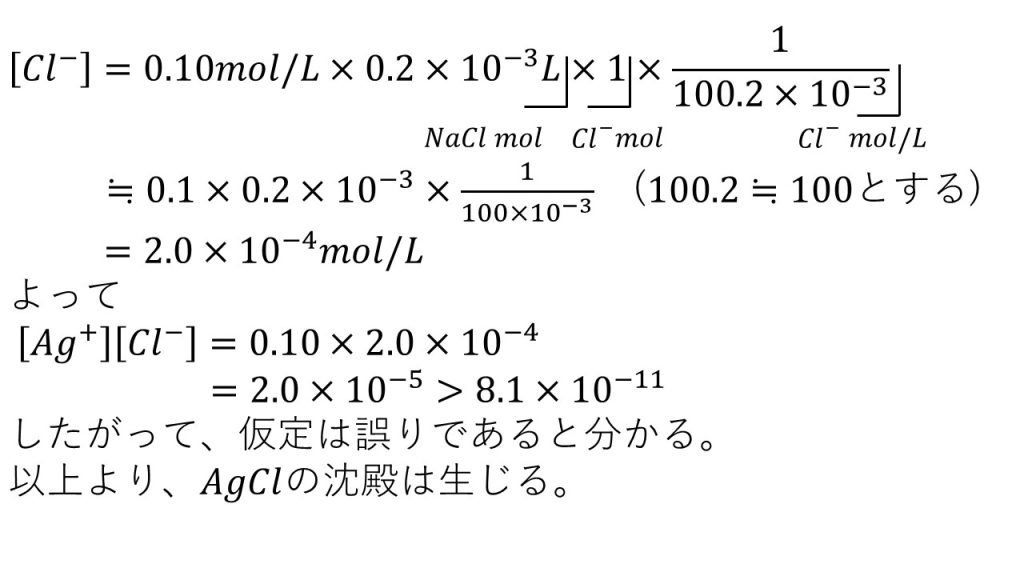
②硝酸銀水溶液に塩酸を加えると白色沈殿を生成し、硝酸銀水溶液にクロム酸カリウム水溶液を加えると赤褐色の沈殿を生じる。これらの沈殿生成による水溶液の体積変化はないものとし、25℃において、Ag+の濃度、Cl-の濃度、CrO42-の濃度が次の関係を満たすとき、それぞれの反応において沈殿が生成し始める。
[Ag+][Cl–]=1.8×10-10(mol/L)2
[Ag]2[CrO42-]=2.0×10-12(mol/L)3
25℃において、1.0L中にCl-0.10molとCrO42-0.010molとを含む水溶液がある。これにAg+を加えていくと、Ag+の濃度が1.8×10-9mol/Lになれば塩化銀の沈殿がはじめて生成する。さらにAg+を追加していくと塩化銀の沈殿がしだいに増加する。
1)クロム酸銀の沈殿が初めて生成するのはAg+の濃度が何mol/Lになったときか。ただし、Ag+を加えたときに水溶液の体積は変化しないものとする。
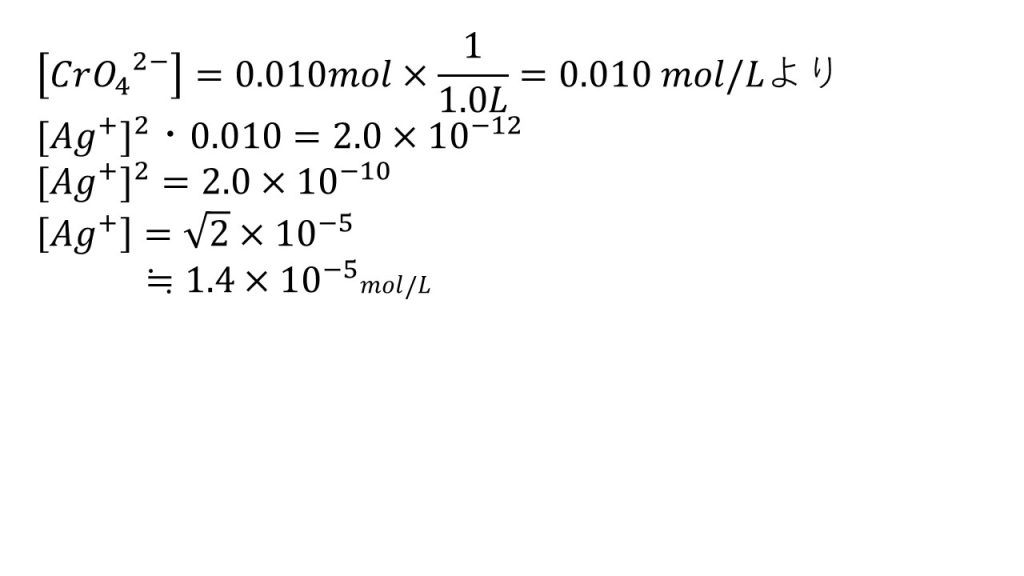
2)このとき水溶液中に存在するCl-の濃度は何mol/Lか。

☆問題のみはこちら→溶解平衡(溶解度積)の計算(問題)
【解説動画】
①溶解平衡(溶解度積)の計算(溶解平衡とは何か、溶解度積=一定の導出、沈殿が生じるかどうかの判断の方法についても解説しています)
②共通イオン効果を扱った問題の解説(共通イオン効果とは何か、図を使った問題の解説もしています)
【その他参考になる解説】
①化学平衡の基本(化学平衡とは何か、可逆反応・不可逆反応、グラフの読み取り、平衡定数の定義、化学平衡の法則・質量作用の法則)
②気体の平衡の計算(化学平衡の法則(平衡定数=一定)から方程式を立てる、平衡定数の求め方についても解説しています)
③電離平衡の基本(弱酸・弱塩基の電離度とpHを求めます。近似についても解説しています)
④溶解度の計算の基本(溶質・溶媒・溶液の表を使った計算の方法を解説しています)
「化学計算の王道」シリーズは『思考訓練の場としての体系化学』(GHS予備校)を参考にしています。
GHS予備校についてはこちら→https://ghs-yobikou.co.jp/
思考訓練シリーズの購入はこちら→https://ghs-yobikou.shop/
~参考~
☆化学計算の王道(化学基礎・理論化学) ←その他の単元の計算問題と解説はこちら
☆化学の解説動画・授業動画一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識テスト一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学の解説・授業・知識・演習問題一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
