(1)解説授業動画
☆YouTubeチャンネルの登録をよろしくお願いします→大学受験の王道チャンネル
(2)解説授業の原稿
今回は共通イオン効果を扱った問題を解説します。
なお今回は溶解平衡や溶解度積については理解できている前提で話を進めていきます。もし理解が不十分な場合は、まずそちらの解説ご覧になってください。
共通イオン効果とは何か?
それではそもそも共通イオン効果とは何かについて確認します。
共通イオン効果とは、溶解平衡の状態にあるところにその平衡に関連するイオンを加えると、溶解度が下がる現象のことです。溶解度が減少するとは、沈殿が増加すると言い換えることもできます。
図を使ってこの現象を確認してみます。

例えば、水溶液中に塩化銀の沈殿があるとき、この水溶液は溶解平衡の状態にあります。そのため、水溶液中にはわずかではありますが銀イオンと塩化物イオンが溶けています。
外から見ると何も変化していないように見ますが、塩化銀は銀イオンと塩化物イオンとなって溶液中に溶け出していたり、銀イオンと塩化物イオンがくっついて結晶となったりする反応が絶えず行われています。
このような溶解平衡の状態にある水溶液に、例えば、銀イオンを加えてみます。
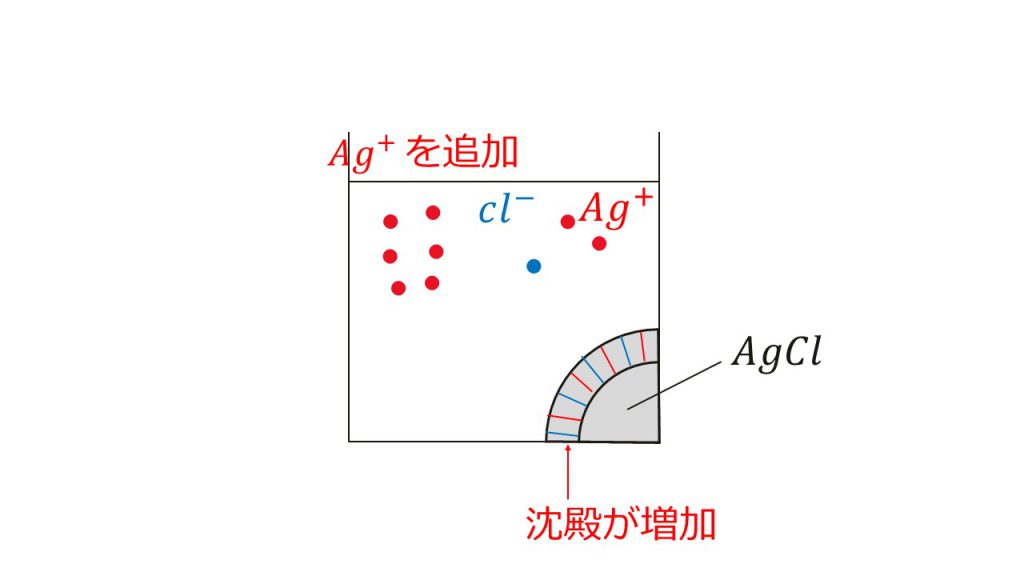
すると塩化銀の溶解度が下がり、塩化銀の沈殿が増加します。これが共通イオン効果です。
共通イオン効果はなぜ起きるのか?
それでは、この共通イオン効果がなぜ起きるのかを、平衡移動と溶解度積の2つの視点で解説します。
平衡移動の視点
まずは平衡移動ですが、溶解平衡の状態にあるときは
AgCl(固) ⇆ Ag++Cl-
のような状態となっています。沈殿している固体の塩化銀が銀イオンと塩化物イオンに電離するのが正反応で、銀イオンと塩化物イオンが結合して結晶となり析出するのが逆反応です。
それではこのような平衡状態にあるとき銀イオンの量を増やすとどうなるでしょうか。
銀イオンの量が増えると、ルシャトリエの原理から銀イオンが減少する方向へ平衡が移動します。今回銀イオンが減少する方向は、左向きの反応なので平衡は左へ移動します。その結果、固体の塩化銀の量が増え、沈殿が増加することになります。
溶解度積の視点
次に溶解度積で共通イオン効果を考えてみます。
溶解平衡の状態にあるので、溶解度積は一定となります。その状態で、銀イオンの量を増やすとどうなるでしょうか。
このままでは銀イオンと塩化物イオンの積は、もとの溶解度積よりも大きくなってしまいますが、そうならないために、AgClとして析出させて、水溶液中の銀イオンと塩化物イオンの量を減少させることで、溶解度積が一定となるようにしているのです。結果として、塩化銀が析出するので沈殿が増加することになります。
これで平衡移動と溶解度積の2つの視点で共通イオン効果を確認することができました。
ちなみに
[Ag+][Cl-]=一定
の式は、AgCl(固) ⇆ Ag++Cl-の溶解平衡の式から作っているので、本質的にはこの2つは同じことを言っているということになります。
問題演習①
まずはこの問題を解きます。
ある温度において[Ag+][Cl-]=1.8×10-10(mol/L)2とし、[Ag+]2[CrO42-]=2.0×10−12(mol/L)3とします。この温度において、Cl-が0.10molとCrO42-が0.010mol含む水溶液1.0LにAgNO3を加えていく。Ag2CrO4の沈殿が生成し始めたときの水溶液に溶けている[Ag+]を求めよ。ただし温度と水溶液の体積は一定であるとし、有効数字2桁で答えます。
まずはAg2CrO4が沈殿し始めたときを考えているので、[Ag+]2[CrO42-]=2.0×10−12(mol/L)3の溶解度積だけを見て答えます。
AgNO3は電解質なので、
AgNO3 → Ag++NO3-
のように電離します。今回、NO3-は溶解平衡に関係ないイオンなので、AgNO3を加えるということは、銀イオンの量を増やすということになります。
CrO42-を含む水溶液に銀イオンを加えていくと、銀イオンのモル濃度がAg2CrO4の溶解度積を満たすものになったときにCrO42-の沈殿が生成し始めます。したがって、[Ag+]2[CrO42-]=2.0×10−12(mol/L)3にCrO42-のモル濃度を代入し、銀イオンのモル濃度を求めるという方針で解いていくことになります。
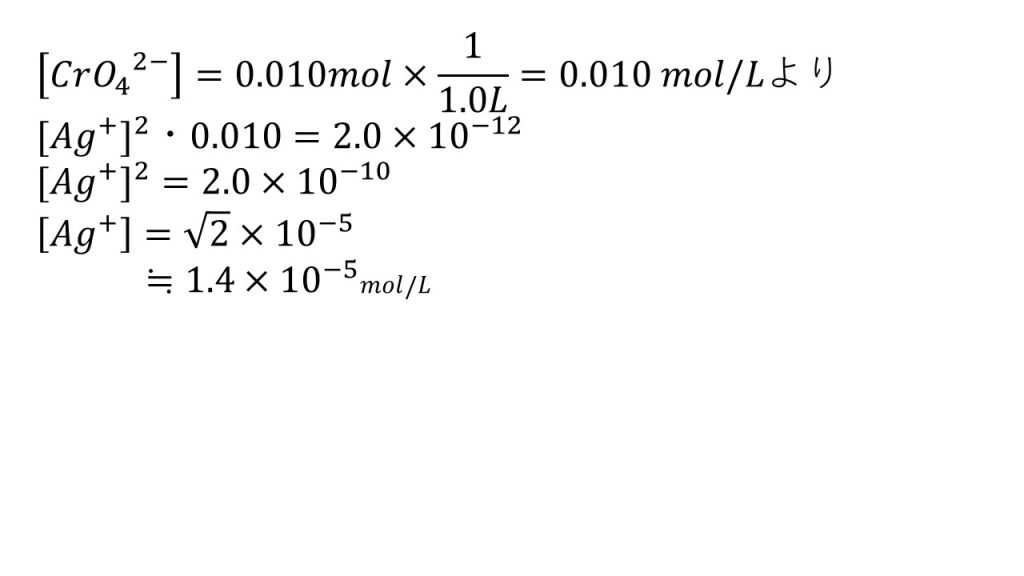
そのために、CrO42-のモル濃度を求めて、[CrO42-]=0.010mol×1/1.0L=0.010molLとします。モル濃度なので体積で割るのを忘れないようにしましょう。
これでCrO42-のモル濃度がでたので、[Ag+]2[CrO42-]=2.0×10−12(mol/L)3に代入して、[Ag+]2×0.010=2.0×10-12となって、[Ag+]=√2.0×10-10となり、[Ag+]≒1.4×10-5mol/Lとなります。
問題演習②
それでは次はこの問題を解いてみます。
ある温度において[Ag+][Cl-]=1.8×10-10(mol/L)2とし、[Ag+]2[CrO42-]=2.0×10−12(mol/L)3とします。この温度において、Cl-が0.10molとCrO42-が0.010mol含む水溶液1.0LにAgNO3を加えていく。Ag2CrO4の沈殿が生成し始めたときに水溶液中に存在するCl-のmol濃度は何か。
この問題は先ほどの問題の続きとなります。先ほどは、Ag2CrO4の沈殿が生成し始めたときの銀イオンのモル濃度を求めましたが、今度はそのときの水溶液中に存在する塩化物イオンのモル濃度を求めてみます。
早速答案を確認します。
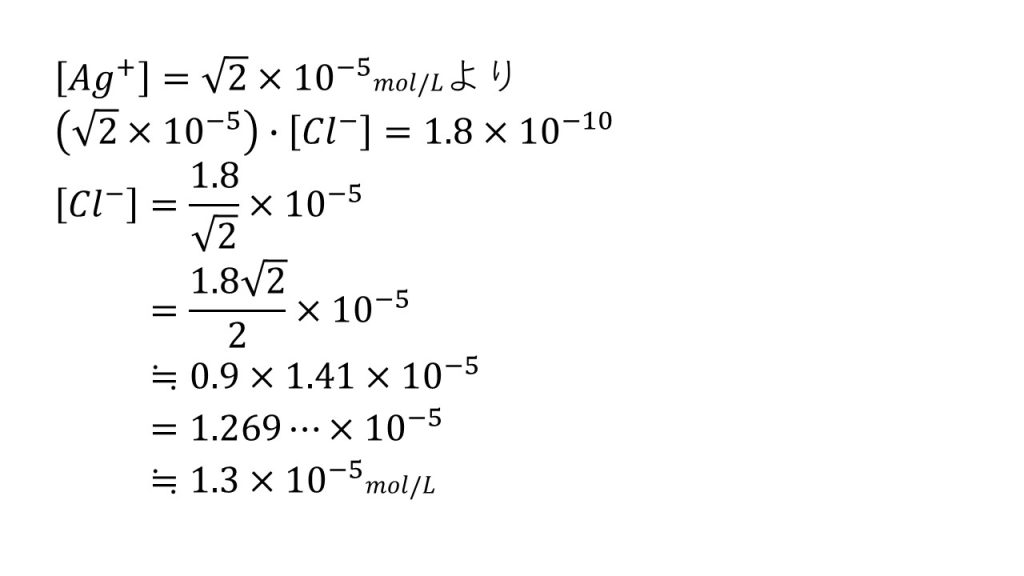
先ほど銀イオンのモル濃度は[Ag+]=√2×10-5となりました。今回は塩化物イオンのモル濃度が知りたいので、この塩化銀の溶解度積[Ag+][Cl-]=1.8×10-10(mol/L)2を使います。つまり、この式に先ほど求めた銀イオンのモル濃度を代入し、方程式を解くと[Cl-]=1.8/√2×10-5となり、分母の有理化をして、√2=1.41として計算すると、[Cl-]≒0.9×1.41×10-5≒1.3×10-5mol/Lとなります。
先ほどの問題もこの問題も答えを出すだけであればそれほど難しくありません。しかしいまいち理解しきれない部分があるのではないでしょうか。そこで今回解いた2つの問題は、一体何をしていたのかを図を使って解説してみようと思います。
図を使った解説
①最初の状態
それでは問題の最初の状態を図で確認します。
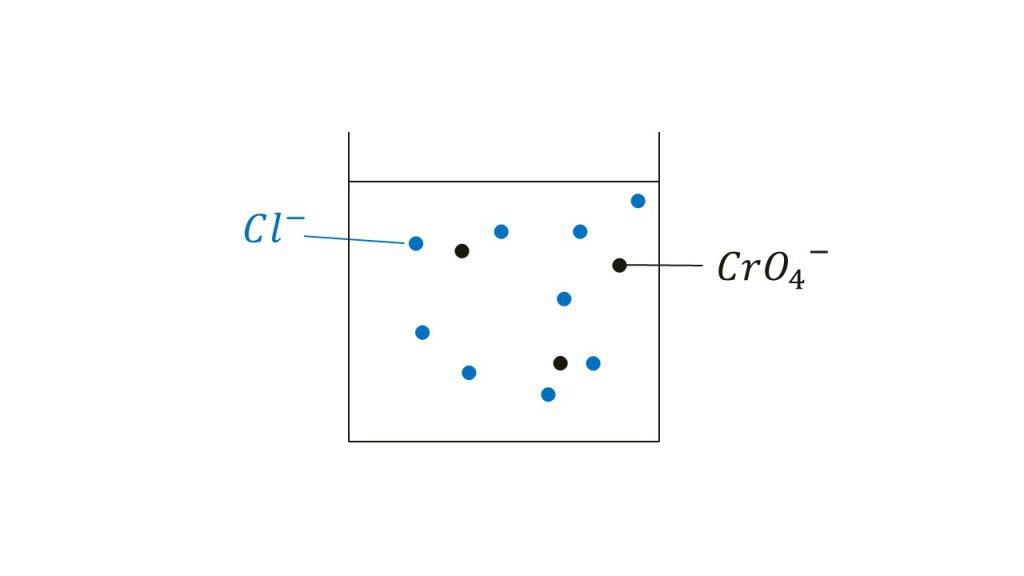
まず最初の水溶液に含まれていたのは塩化物イオンとクロム酸イオンです。この2つのイオンだけが存在する水溶液では、沈殿は形成しません。なぜなら塩化物イオンとクロム酸イオンはともに陰イオンで結合することはないからです。
②銀イオンを加えていく
そして、その状態の水溶液に硝酸銀つまり銀イオンを加えていきます。
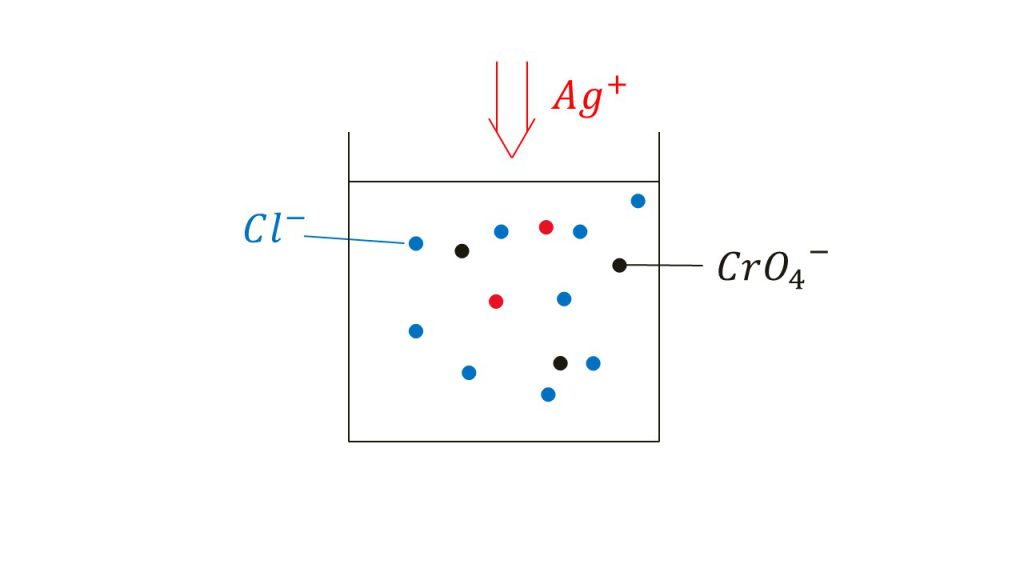
ごくごくわずかに銀イオンを加えただけであれば、塩化銀の沈殿もクロム酸銀の沈殿もできません。もう少し具体的にいうと、銀イオンのモル濃度が塩化銀の溶解度積や、クロム酸銀の溶解度積を満たさないものであれば沈殿を形成せずに銀イオンを溶かすことができます。
③まずは塩化銀の沈殿が生成
このまま銀イオンを加えていくと、まずは塩化銀の沈殿が生成し始めます。
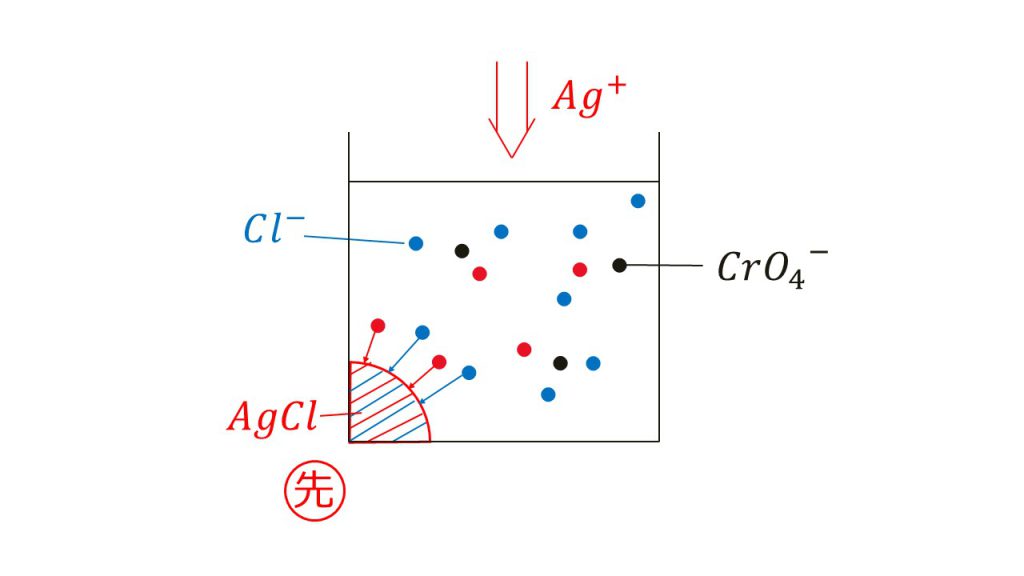
ポイントはクロム酸銀の沈殿ができるよりも先に塩化銀の沈殿が生成します。
なぜ塩化銀はクロム酸銀よりも早く沈殿を形成するかは計算することで分かります。
クロム酸銀の沈殿が生成し始めるときの銀イオンのモル濃度は、問1で求めた[Ag+]=1.4×10-5mol/Lです。それに対して、塩化銀が沈殿を形成し始めるときの銀イオンのモル濃度は、この塩化銀[Ag+][Cl-]=1.8×10-10(mol/L)2の溶解度積に、塩化物イオンのモル濃度、今回は0.10mol/Lを代入し、計算すると[Ag+]=1.8×10-9mol/Lとなります。
1.4×10-5mol/Lと1.8×10-9mol/Lを比べると、塩化銀の沈殿が形成し始めるときの銀イオンのモル濃度の方が圧倒的に小さいです。
そのため銀イオンを加えていけば、クロム酸銀の溶解度積に達するよりも先に、塩化銀の溶解度積に達するので、塩化銀の沈殿が先に形成されるのです。
④次にクロム酸銀の沈殿が生成(塩化銀の沈殿は増加している)
そしてこのまま銀イオンを追加していくと、銀イオンのモル濃度が[Ag+]=1.4×10-5となるときにクロム酸銀の沈殿が形成し始めます。
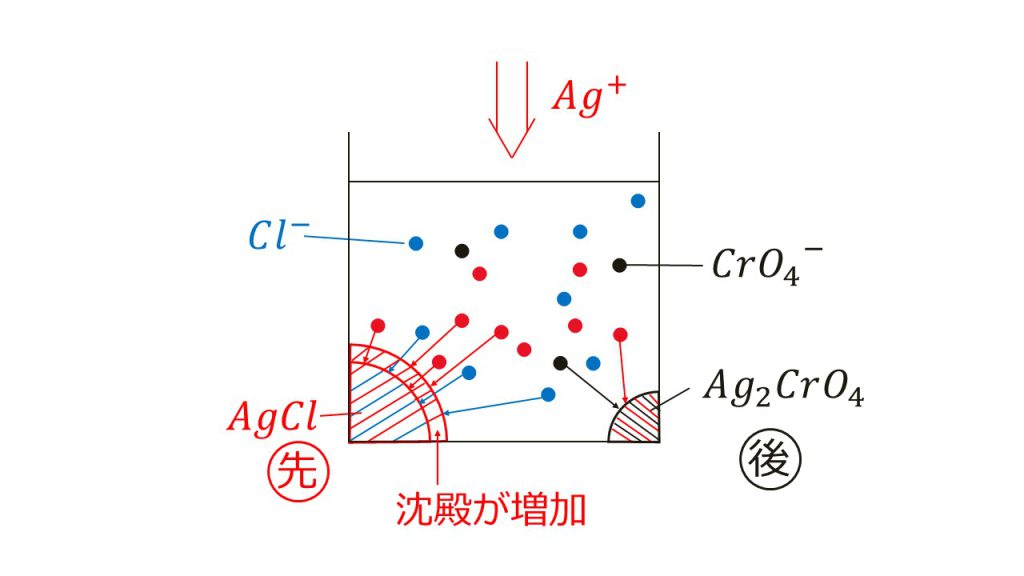
このように塩化銀の沈殿ができてから、そのあとでクロム酸銀の沈殿ができるということになるですが、さらに重要なことがあり、それは、塩化銀の沈殿ができ始めてからクロム酸銀の沈殿が形成し始めるまでの間に、塩化銀の沈殿は増え続けるということです。
なぜ塩化銀の沈殿は増えるのかというと、それは共通イオン効果によるものなのです。つまり、銀イオンを追加していけばいくほど共通イオン効果により塩化銀の沈殿は増加し、それはつまり水溶液中の塩化物イオンの量も減少するということになります。
なぜなら塩化銀の生成には塩化物イオンが必要だからです。そして、その量がどれぐらい減少したかを計算したのが問2だったのです。
実際に、最初は0.1mo/Lだった塩化物イオンのモル濃度は、クロム酸銀の沈殿ができ始める頃には、約1/10000の1.3×10-5mol/Lにまで減少しています。これが今回解いた問題で起きていた現象だったのです。
(3)解説授業の内容を復習しよう
(4)溶解平衡(溶解度積)の解説一覧
①溶解平衡(溶解度積)の計算(溶解平衡とは何か、溶解度積=一定の導出、沈殿が生じるかどうかの判断の方法についても解説しています)
②共通イオン効果を扱った問題の解説(共通イオン効果とは何か、図を使った問題の解説もしています)
(5)参考
☆化学の解説動画・授業動画一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識テスト一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学の解説・授業・知識・演習問題一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学の語呂合わせ(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
「化学計算の王道」シリーズは『思考訓練の場としての体系化学』(GHS予備校)を参考にしています。
GHS予備校についてはこちら→https://ghs-yobikou.co.jp/
思考訓練シリーズの購入はこちら→https://ghs-yobikou.shop/
