(1)解説授業動画
☆YouTubeチャンネルの登録をよろしくお願いします→大学受験の王道チャンネル
(2)解説授業の原稿
今回は平衡移動とルシャトリエの原理について解説します。
なお、平衡の基本については、理解している前提で話を進めていきます。もし理解が不十分な場合は、まずそちらの解説をご覧になってください。
平衡移動とは?
それでは平衡移動とルシャトリエの原理の定義を確認します。
平衡移動とは平衡状態にあるものの温度・圧力・濃度を変化させることによって、その新しい条件に応じた平衡状態となることです。つまり、元の平衡状態から条件を変えることで、新しい平衡状態に移動するということです。
では、どのようにして新しい平衡状態に移動するのかというと、正反応または逆反応が進行して、新しい平衡状態を作ります。
平衡移動と平衡定数
ここで注意したいのが、温度・圧力・濃度の3つの条件を平衡を支配する条件と言ったりもしますが、この3つの条件の中に温度が入っていることに注意しましょう。
「化学平衡の法則」は「温度を変えない限り平衡定数が一定である」という法則でしたが、それはつまり、温度を変えてしまうと平衡定数も変わってしまうということを意味しています。そのため温度を変えた場合は、平衡が移動するだけでなく平衡定数も変化するということに注意しましょう。
ちなみに圧力と濃度を変えても、温度を変えない限り平衡定数は変わらないので、圧力と濃度を変化させた場合は平衡は移動するけど平衡定数は変わらないということになります。
「右へ平衡が移動する」「左へ平衡が移動する」
そして、平衡移動は正反応または逆反応が進行することによって起きるのですが、正反応が進行することを「右へ平衡が移動する」、逆反応が進行することを「左へ平衡が移動する」と言ったりもします。
ルシャトリエの原理
では、平衡がどちらの方向に移動するかをどのように決めているのでしょうか。それを決める原理がルシャトリエの原理です。
ルシャトリエの原理とは、「化学反応が平衡状態にあるとき、外部から温度・圧力・濃度を変えると、その影響を緩和する方向へ平衡が移動する」という原理です。
ポイントは温度・圧力・濃度の変化の影響を緩和する方向へ平衡が移動するということです。緩和する方向とは、反対の方向あるいは対抗する方向と考えてもいいです。
例えば、温度を上げたのであれば、温度を下げる方向へ平衡が移動し、圧力を上げたのであれば、圧力が下がる方向へ移動し、ある物質の濃度を上げたのであれば、その物質の濃度が下がる方向へ平衡が移動するのです。
このことは実際に問題を解きながら確認していきましょう。
例を使ってルシャトリエの原理を確認しよう
それでは、以下の窒素と水素が合成してアンモニアとなる反応の平衡移動を、ルシャトリエの原理を使って考えてみます。
N2+3H2 ⇆ 2NH3
- この反応のことを「ハーバー・ボッシュ法」と言います→ハーバー・ボッシュ法の解説(なぜ高温高圧で行うのか、なぜ人類にとって重要なのか)
まず平衡移動の問題を考えるときに前提となっていることを確認します。それは、ある条件を変えるということは、その条件以外は変えないという前提です。
それではこの点に注意しながら、以下のように条件を変えたときに、平衡がどの方向に移動するか考えていきましょう。
①アンモニアの濃度を増加させる
まずはアンモニアを加えてみます。
アンモニアを加えるということはアンモニア濃度が増加するということなので、そのアンモニアの濃度が増加するという変化を緩和する方向、つまりアンモニアが減少する方向に平衡が移動するので、逆反応が進行し平衡は左に移動します。
このように、変化に対してそれとは反対するように平衡移動させるという原理がルシャトリエの原理です。
②圧力を増加させる
続いて圧力を増加させてみます。圧力を増加させるとは、今回はすべて気体なので全圧を増加させるということになります。
先に答えを言うと、圧力を増加させた場合は右方向に平衡が移動します。
ではなぜ右に平衡が移動するのでしょうか。それは粒子数が減少する方向だからです。
ただ、この理由と答えをちゃんと理解しているでしょうか。おそらく多くの人が、「圧力が増加すると言われたら、なぜかは知らないけど粒子数が減少する方向に移動すると言われたので、とりあえず係数を足してみて、係数の合計が小さくなる方に移動する」と答えているのではないでしょうか。この理由も問題の解き方も答えも合ってはいるのですが、これらを正しく理解していないと応用させることができなくなってしまいます。
まずは、なぜ右側に移動すると粒子数が減るのかを確認します。
右向きの反応が起きると窒素1粒と水素3粒を使ってアンモニア2粒ができます。つまりこの右向きの反応を起こせば、合計4粒が合計2粒に減るので、その差の2粒ずつ粒子数が減っていくことになります。そのため粒子数が減少する方向は右方向となるのです。
それでは次は、なぜ圧力が増加すると粒子数が減少する方向に平衡が移動するのかを確認します。
これは、「気体の圧力は気体分子の衝突によって生じる」という考え方が分かっていれば、理解できると思います。
つまり気体の圧力とは、下図のように、気体分子が壁に衝突することによって生じていると考えることができるので、気体の圧力は気体分子の数に比例すると言えます。
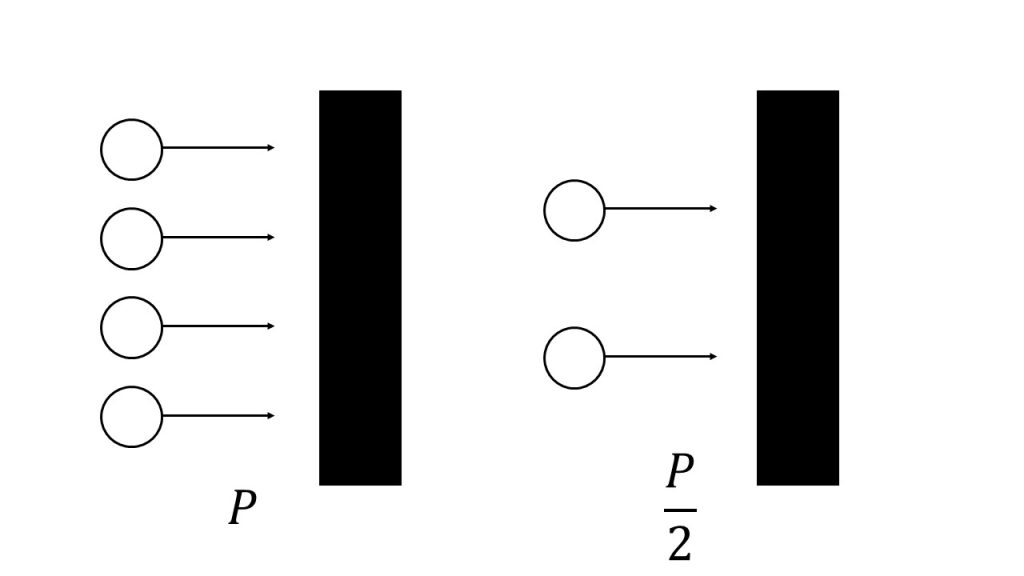
圧力を増加させられると、ルシャトリエの原理から圧力を減らそうとします。気体の圧力は気体の分子数に比例するので、気体の圧力を減らすためには、気体の分子数を減らす必要があります。
したがって、外部から圧力を増加させられた場合は、ルシャトリエの原理より圧力を減少させたいので、圧力を減少させるために粒子数を減少させます。それはつまり、右向きに反応を進行させるということなので、平衡は右に移動します。
このように、圧力変化に対する平衡移動はその原理からしっかりと説明できるようになっておきましょう。
③体積を減少させる
続いて体積を減少させると平衡はどのように移動するでしょうか。
体積を減少させるということは、下図のように容器の体積を減少させるということであり、容器の体積が小さくなると気体分子の壁への衝突回数が増えるので、圧力は増加することになります。
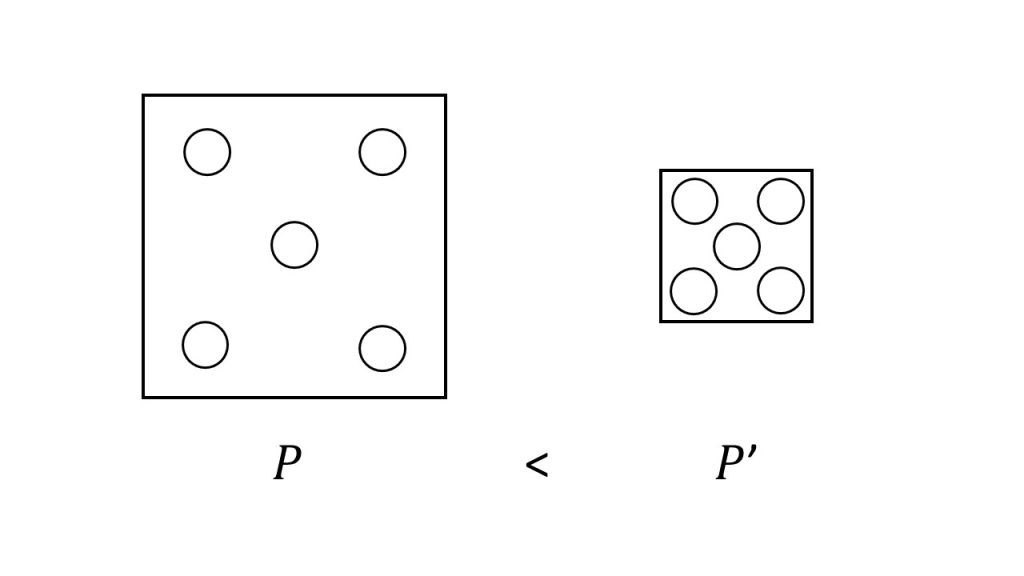
そのため体積を減少させるという条件の変化は、圧力を増加させるという条件の変化と同じことなので、先ほどと同じ右へ平衡が移動することになります。
④発熱反応か吸熱反応か
それでは次は、以下のような問題を解いてみましょう。
加熱するとアンモニアは減少した。では正反応、つまり右向きの反応は発熱反動か吸熱反応か考えてみましょう。
まずポイントとなるのが、条件を変えるとアンモニアが減少した、つまり左へ平衡が移動したということです。そして、どのように条件を変えたかというと加熱する、つまり温度を上げました。
そこでルシャトリエの原理から考えると、温度を上げた場合は温度を下げる方向へ平衡が移動するので、左への平衡移動は温度を下げる方向であるということが分かります。そして、温度を下げる反応とは吸熱反応のことなので、左つまり逆反応は吸熱反応であるため、正反応は発熱反応となります。
このように、平衡移動から発熱反応か吸熱反応かを考えることができます。
そのため、冷却すると平衡がどのように移動するかというと、ルシャトリエの原理より温度を上げようとして発熱反応の方向に平衡が移動するので、右に平衡が移動します。
⑤アルゴンを加える(体積一定)
次は、アルゴンを加えてみましょう。このようにアルゴンを加えたときに、平衡がどうなるかについてよく質問を受けます。ぜひ今回の解説で理解するようにしましょう。
まずアルゴンのように反応に関係ない気体を加える場合は、体積一定なのかそれとも全圧一定なのかをよく確認しましょう。これによって答えが変わってきます。
まずは、温度と体積が一定のときにアルゴンを加えたら平衡がどうなるかを考えてみましょう。
先に答えを言うと、この場合は平衡移動はしません。
では、なぜ平衡移動しないのかを確認していきます。
体積が一定であるということは大きさが変わらない容器の中に、気体を入れるということになります。つまり窒素や水素やアンモニアが入っている容器の中に、下図のようにアルゴンを加えるわけですが、アルゴンを加えたところでこの反応には関係ないので、窒素や水素やアンモニアにとっては、アルゴンが加わる前と加わった後で何も状況は変わりません。
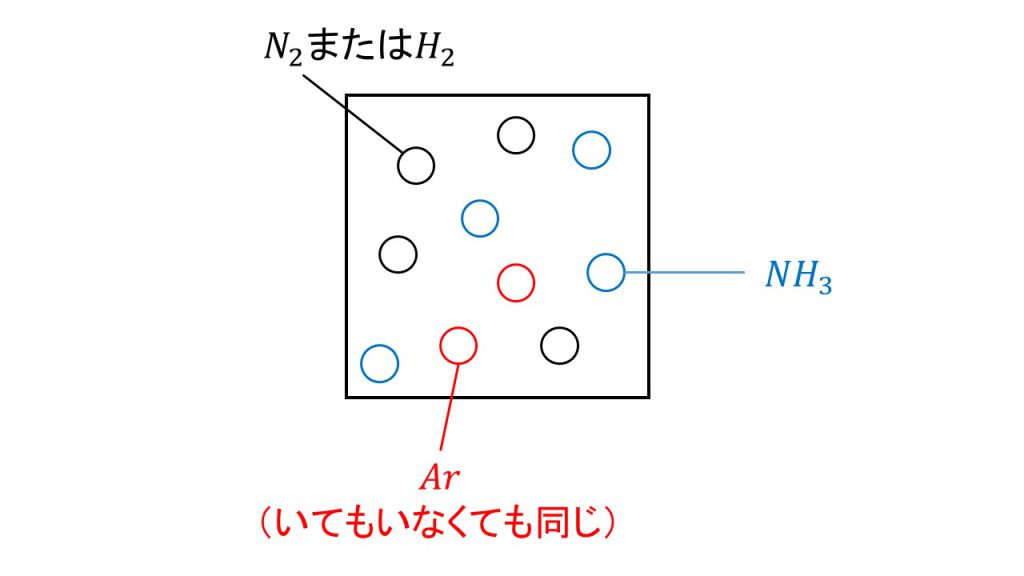
つまり窒素や水素やアンモニアにとって、アルゴンはいてもいなくても同じ存在なので平衡移動することはありません。
ただし注意点として、気体の総粒子数自体は増えているので、この4つ(窒素・水素・アンモニア・アルゴン)の混合気体の全圧は、アルゴンが追加した分だけ増加することになります。
⑥アルゴンを加える(全圧一定)
そして次は、温度と全圧を一定にしたままアルゴンを加えてみます。つまり、外部からの圧力は変えないまま容器の大きさを変えることができる、ということになります。
この場合は全圧が決められているので、追加したアルゴンの分圧の分だけ窒素と水素とアンモニアの分圧の合計が減少することになります。つまり、アルゴンを加える前はこの3つ(窒素・水素・アンモニア)で全圧でしたが、アルゴンが加わったことで、この4つ(窒素・水素・アンモニア・アルゴン)で全圧としないといけないので、加わったアルゴンの分だけ残り3つの分圧が減少することになります。
こうなると、この3つ(窒素・水素・アンモニア)の圧力が減少したということなので、ルシャトリエの原理が働き、圧力増加の方へ平衡が移動をすることになり、それはつまり粒子数を増加する方向ということなので、粒子数の合計が増加する方向、つまり左側へ平衡が移動することになります。
このように、アルゴンなど反応に関係ない気体を加える場合は条件をよく確認して、反応に関係する物質の条件が変化するか変化しないかを確認するようにしてください。
⑦触媒を加える
それでは次は触媒を加えたらどうなるか考えてみます。
結論から言うと、平衡移動はしません。
なぜなら触媒を加えることで反応速度が大きくなるのですが、それは正反応も逆反応も同じ割合で反応速度が大きくなるので、触媒を加える前と加えた後で平衡に達した後の状態は変わることはないからです。
変わるのは平衡に達するまでの時間なので平衡移動とは関係ありません。そのため触媒を加えても平衡移動することはありません。
- 触媒と反応速度の関係についてはこちらも確認してください→化学平衡の基本(化学平衡とは何か、可逆反応・不可逆反応、グラフの読み取り、平衡定数の定義、化学平衡の法則・質量作用の法則)
二酸化窒素と四酸化ニ窒素の平衡
それでは最後にこの反応の平衡移動を考えています。
2NO2 ⇆ N2O4
この反応は二酸化窒素と四酸化二窒素の反応です。この反応に関しては平衡移動だけでなく、色の変化をよく問われるのでそちらも確認しておきます。
圧力変化による平衡移動
まずは平衡移動ですが、圧力を増加した場合はルシャトリエの原理から圧力を減少する方向、つまり粒子数が少ない方向へ平衡が移動するので、右へ移動することになります。
また圧力を減少させるときは、ルシャトリエの原理より圧力を増加させる方向、つまり粒子数が増加する方向へ平衡が移動するので、左へ平衡が移動することになります。
ここまでは先程と同じ考え方で出来ます。
色の変化
次に色の変化を考えてみます。
まず確認しないといけないのは、二酸化窒素は赤褐色で、四酸化二窒素は無色であるということです。そのため、二酸化窒素がたくさんあればそれだけ濃い赤褐色となり、逆に二酸化窒素が少なければ色は薄くなります。
それでは、下図のような容器に入れて圧力を変えてみると色がどのように変化するかを確認していきます。
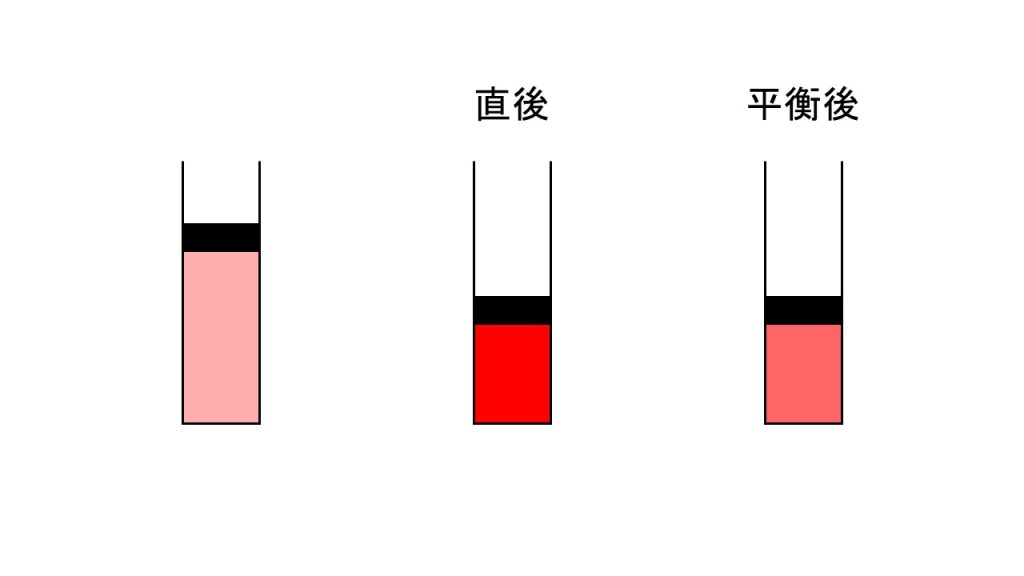

真ん中は膨張または圧縮した直後であり、一番右は平衡に達した後であるとします。また、平衡が右へ移動するということはNO2は減少するということであり、平衡が左へ移動するということはNO2は増加するということになります。
これらを踏まえた上で、まずは圧縮して圧力を増加した場合の色の変化を考えてみると、圧縮した直後は赤褐色が濃くなり、その後、赤褐色は薄くなります。つまり、圧縮した直後は非常に濃くなり、そこから時間が経つと薄くなっていくということになります。
なぜこのようになるのかというと、圧縮した直後はまだ平衡移動が始まっておらず、体積を小さくしたことによってNO2の濃度が大きくなり、赤褐色が濃くなるのです。そして、平衡移動が始まるとNO2は減少するので、直後のときよりも赤褐色は薄くなります。
次に膨張させて圧力を減少させた場合、色の変化はどのようになるのかというと、膨張した直後は赤褐色は薄くなり、その後、赤褐色は濃くなります。
こちらをなぜそうなるのかというと、膨張させて体積を大きくした直後はまだ平衡が始まっておらず、体積が大きくなった分NO2の濃度が小さくなるので赤褐色は薄くなります。しかし、平衡が移動するにつれてNO2は増加するので、徐々に赤褐色は濃くなっていくのです。
このように平衡移動は一瞬で起こることはなく時間をかけて起こるので、色の変化を考えるときは条件を変えた直後の色から考えていかないといけない点に注意しましょう。
(3)解説授業の内容を復習しよう
(4)気体の平衡の解説一覧
①化学平衡の基本(化学平衡とは何か、可逆反応・不可逆反応、グラフの読み取り、平衡定数の定義、化学平衡の法則・質量作用の法則)
②平衡移動(ルシャトリエの原理)の解説(アルゴンを加える問題、二酸化窒素と四酸化二窒素の平衡の色の変化についても解説しています)
③気体の平衡の計算(化学平衡の法則(平衡定数=一定)から方程式を立てる、平衡定数の求め方についても解説しています)
④圧平衡定数の導出(濃度平衡定数・圧平衡定数とは何か、平衡定数の単位についても解説しています)
⑤圧平衡定数の計算の解説(気体の平衡を考えるために必要なものについても解説しています)
⑥ハーバー・ボッシュ法の解説(なぜ高温高圧で行うのか、なぜ人類にとって重要なのか)
(5)参考
☆化学の解説動画・授業動画一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識テスト一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学の解説・授業・知識・演習問題一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
