(1)解説授業動画
☆YouTubeチャンネルの登録をよろしくお願いします→大学受験の王道チャンネル
(2)解説授業の原稿
今回はアルミニウムの溶融塩電解について解説します。
溶融塩電解とは何か
まずはそもそも溶融塩電解とは何かについて確認します。
溶融塩電解とはイオン化傾向の大きい金属を析出させるために、水あるいは水溶液を使わずに電気分解をすることです。
「イオン化傾向の大きい金属」を具体的に言うと、カリウムやカルシウムやナトリウムやマグネシウムやアルミニウムなどの金属のことです。
これらの金属は水を使ったり、あるいは水溶液にしたりして電気分解を行っても、析出させることが出来ません。
そのため、これらの金属を電気分解で析出させるためには、塩化ナトリウムや酸化アルミニウムなどのこれらの金属の化合物をそのまま融解して液体の状態となったものに、直接電極を刺して電気分解を行わないといけないのです。
なぜ水を使ってはいけないのか
ではなぜ水を使ってはいけないのでしょうか?
その理由は水素が還元されてしまうからです。つまり、これらの金属の還元反応よりも、以下の反応の方が優先されて起きてしまうのです。
2H+ + 2e- → H2
では、なぜこれらの金属の還元よりも水素の還元が優先されてしまうかというと、これらの金属は水素よりもイオン化傾向が大きいからです。
イオン化傾向が大きいということは酸化されやすく、還元されにくいということなので、周りに水素イオンや水などがある状況だと、これらの金属が電子を受け取るよりも先に、水素が電子を受け取ってしまうので、これらの金属は還元されて析出することはありません。
そのため、これらの金属を電気分解で析出させるためには、水を使わない溶融塩電解でないといけないのです。
①アルミナの融解
それではアルミニウムの溶融塩電解の流れを解説します。アルミニウムの溶融塩電解は大きく2つの段階があります。
まず1つめの段階は、アルミニウムの原料であるボーキサイトから取り出したアルミナと呼ばれる酸化アルミニウムの融解です。
つまり酸化アルミニウムを融解させ、イオンの状態とし、電気分解ができる状態にしないといけません。しかし酸化アルミニウムの融点は約2000℃と、とても高温で、そのまま融解させるのは難しいです。
そこで使うのが氷晶石です。融解させた氷晶石にアルミナを溶かしながら加えていくことで、融点が1000℃以下となります。このようにすることで比較的容易にアルミナを融解させることが出来るようになります。
では、なぜアルミナは氷晶石と一緒に溶かすことで融点が下がるのかというと、凝固点降下現象が起きているからと考えるとよいでしょう。つまり純溶媒であるアルミナに溶質である氷晶石を加えることで、凝固点つまり融点が下がるという現象が起きていると考えることが出来ます。
②電気分解
そしてアルミナを融解させることが出来たら、次の段階は電気分解をします。イメージとしては下図のように電気分解をします。
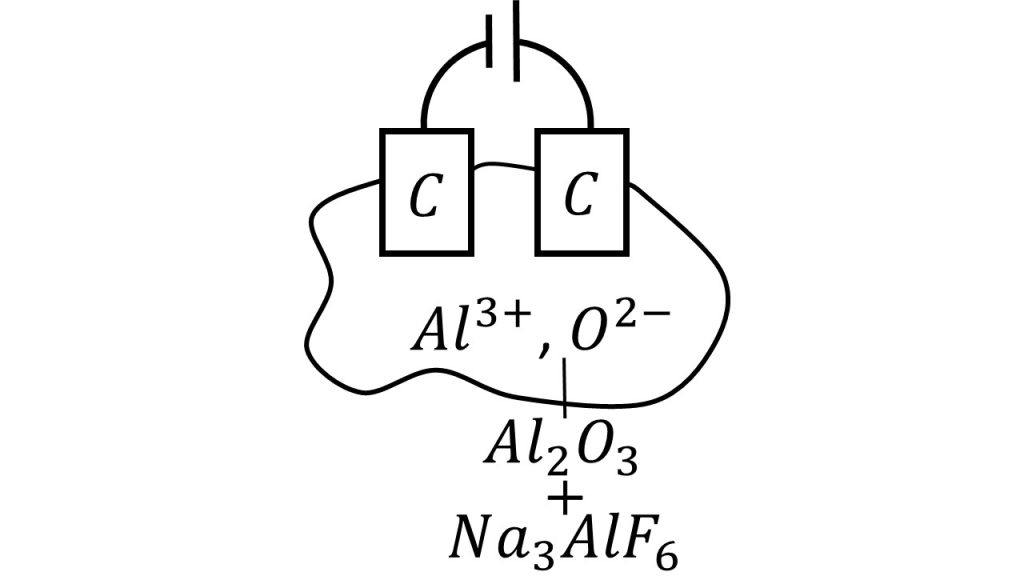
ドロドロに溶けて液状となった酸化アルミニウムと氷晶石に、炭素電極を刺して電気分解を行います。ただしこの図はあくまでもイメージで、実際はもっとちゃんとした装置で、アルミニウムの溶融塩電解は行っています。
陰極と陽極の反応
それでは陰極と陽極での反応を確認してみます。
陰極では還元反応が起きるのでアルミニウムイオンが還元されてアルミニウムとなります。
Al3+ + 3e- → Al ・・・(ア)
そして、陽極では酸化反応が起きるのですが、炭素が酸化されて一酸化炭素または二酸化炭素となります。
C + O2- → CO + 2e- ・・・(イ)
C + 2O2- → CO2 + 4e- ・・・(ウ)
注意したいのが、酸化されているのは炭素であるということです。普通の電気分解であれば炭素電極は酸化還元反応をしない電極として扱いますが、今回のように1000℃近い状態であれば、炭素の反応性が高くなり、炭素電極自体が酸化されて、電子を出すようになるのです。
そのため両極の炭素は消耗していくので、アルミニウムの溶融塩電解を続けて行うためには、両極に炭素を補給し続けなければいけません。
アルミニウムの溶融塩電解全体の反応式
このアルミニウムの溶融塩電解の反応を陰極の反応と、両極の二酸化炭素が発生する方の反応を使ってまとめて書いてみるとこのようになります。
2Al2O3 + 3C → Al + 3CO2
(ア)の両辺を4倍したものと、(イ)の両辺を3倍したものを足し合わせました。
要するにアルミニウムの溶融塩電解をまとめると、酸化アルミニウムと炭素を熱エネルギーと電気エネルギーを使って酸化還元反応を起こし、アルミニウムを還元させて析出させる反応であるということになります。
アルミニウムの製錬は19世紀末から始まる
最後にアルミニウムの製錬に関して1点だけ補足しておきます。
それはアルミニウムを単体として使えるようになったのは、19世紀末のことであるという話です。
クラーク数上位4つ
この話をするためにまずはクラーク数の上位4つを確認します。クラーク数とは地球上に存在する元素の割合であると考えてください。
地球上に最も多く存在する元素は酸素で、次に多いのがケイ素で、その次がアルミニウムで、4番目が鉄です。「おっしゃって(O, Si, Al, Fe)」といった語呂合わせがよく使われます。
このようにアルミニウムは地球上で3番目に多い元素です。それなのに使われるようになったのが19世紀末なのです。鉄などは何千年も前から使われていることを考えるとつい最近のことなのです。
理由①:大量の電気が必要
なぜ19世紀末なのかというと2つの理由があります。
1つめの理由が、人類が大量の安定した電気を使えるようになったのが、この頃だからです。
先ほども確認した通り、アルミニウムを製錬するためには電気分解が必要となります。鉄などは熱エネルギーだけで製錬できますが、アルミニウムの製錬は熱エネルギーと電気エネルギーが必要なのでそれを供給するための技術が確立するまで、アルミニウムの単体を使うことが出来なかったのです。
理由②:氷晶石の利用
2つ目の理由は、氷晶石を使ってアルミナを融解するやり方を発見したのが、19世紀末でした。これはホールとエルーという人が発見しました。
これらの理由により、地球上にたくさん存在し、かつ便利な金属であるアルミニウムを、人類が使えるようになったのは、比較的最近の19世紀末であるということは知っておいても良いでしょう。
(3)解説授業の内容を復習しよう
②両性金属Al, Zn, Sn, Pb(無機化学)知識テスト
③電気分解の計算 ←アルミニウムの溶融塩電解の問題もあります。
(4)電気分解の解説一覧
①電気分解の計算の基本(電気分解における陰極と陽極での反応の順番のルールについても解説しています)
②電気分解における陰極と陽極の反応の順番ルール(「電気分解の計算の基本」から切り抜いています)
④アルミニウムの溶融塩電解(そもそも溶融塩電解とは何か、なぜ水を使ってはいけないのか、氷晶石、クラーク数などについても解説しています)
⑤「銅の電解精錬」完全解説(黄銅鉱から粗銅への製錬、粗銅が陽極で純銅が陰極の理由、不純物の酸化、陽極泥、計算問題の考え方、銅の電解精錬特有の式の立て方についても解説しています)
(5)工業的製法の解説授業一覧
①アルミニウムの溶融塩電解(そもそも溶融塩電解とは何か、なぜ水を使ってはいけないのか、氷晶石、クラーク数などについても解説しています)
②「鉄の製錬」完全解説(原料と生成物、製錬の過程(反応式)、石灰石の役割、還元の過程、四酸化三鉄についても解説しています)
③「銅の電解精錬」完全解説(黄銅鉱から粗銅への製錬、粗銅が陽極で純銅が陰極の理由、不純物の酸化、陽極泥、計算問題の考え方、銅の電解精錬特有の式の立て方についても解説しています)
④ハーバー・ボッシュ法の解説(なぜ高温高圧で行うのか、なぜ人類にとって重要なのか)
(6)参考
☆電池と電気分解(理論化学)の解説・授業・知識・演習問題一覧
☆化学の解説動画・授業動画一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識テスト一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学の解説・授業・知識・演習問題一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
