☆問題のみはこちら→溶解度の計算(問題)
☆解説授業①:溶解度の計算の基本(溶質・溶媒・溶液の表を使った計算の方法を解説しています)
☆解説授業②:結晶水をもつ固体(硫酸銅(Ⅱ)五水和物)の溶解の計算(硫酸銅(Ⅱ)五水和物の性質についても解説しています)
※原子量:H=1, C=12, O=16, Na=23, S=32, Cu=64
※以下の問題は全て有効数字3桁で答えよ。
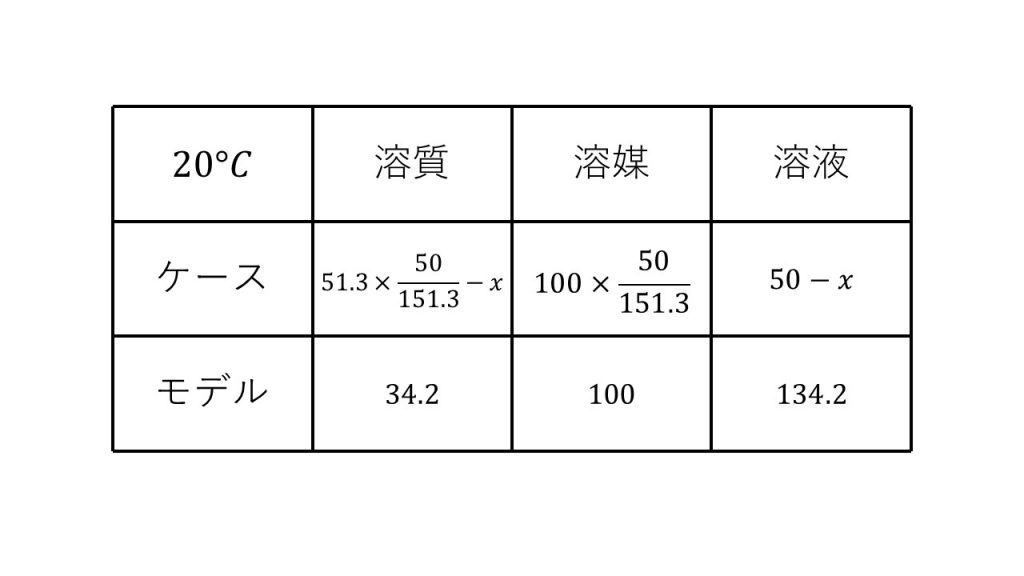
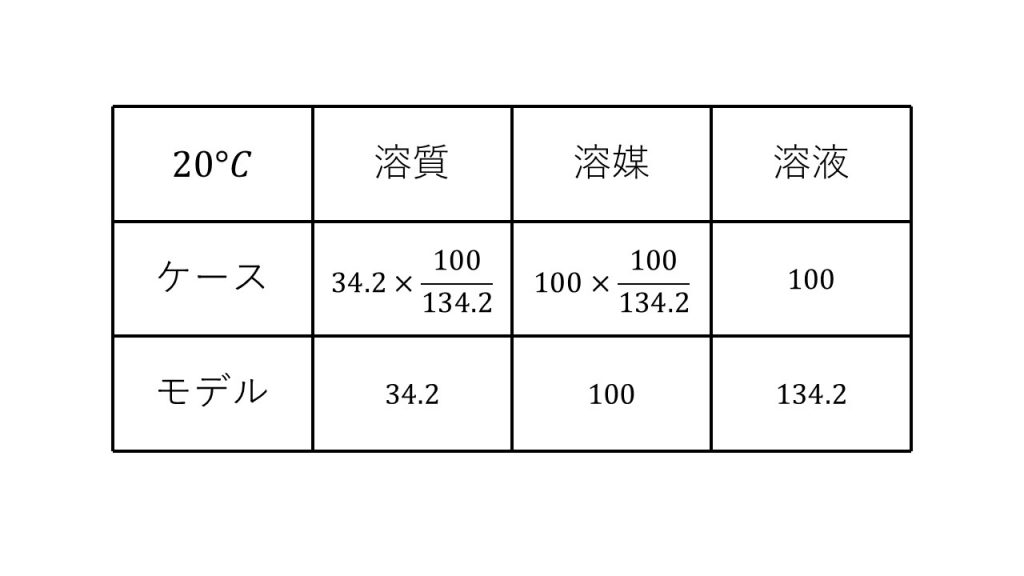
①塩化カリウムの水に対する溶解度は20℃で34.2、80℃で51.3である。80℃における飽和溶液50gを20℃に冷却すると、何gの塩化カリウムが析出するか。
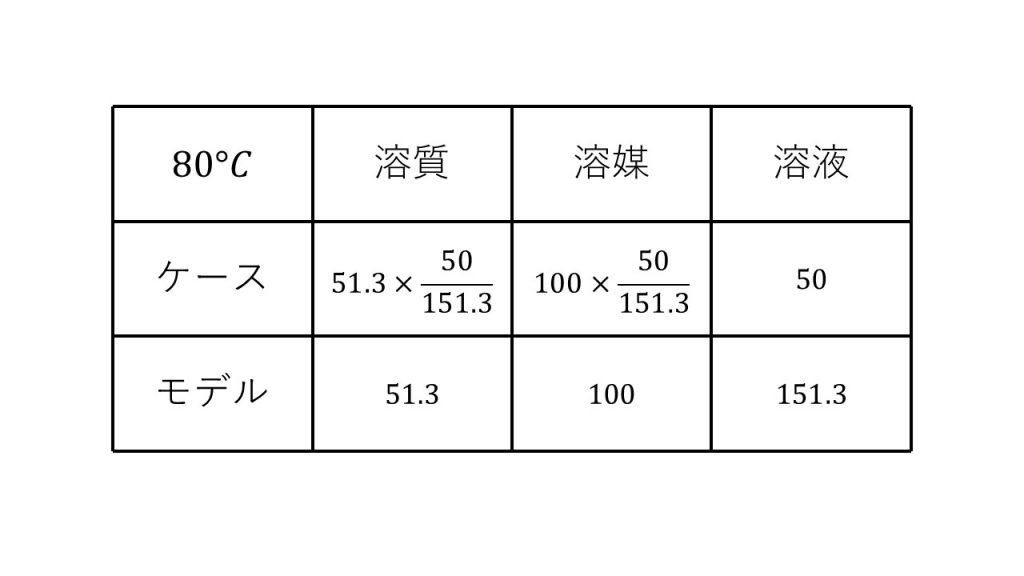
求める質量をx[g]とする。
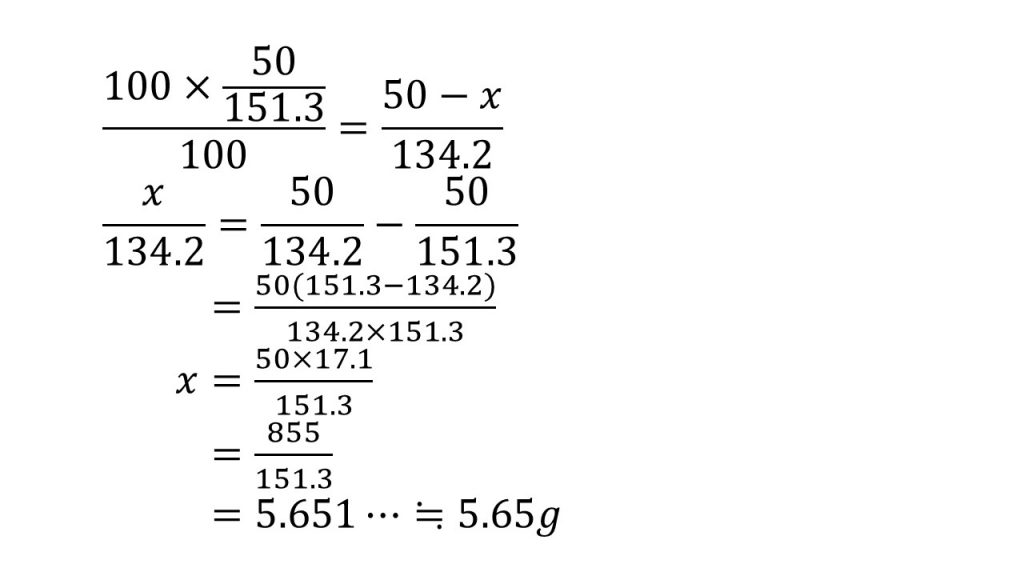
②塩化カリウム200gを水500gに加え、加熱して完全に溶かした。この水溶液から一定量の水を蒸発させた後、20℃まで冷却すると塩化カリウムの結晶149gが析出した。蒸発させた水は何gか。塩化カリウムの水に対する溶解度は20℃で34.2である。
求める水の質量をx[g]とする。


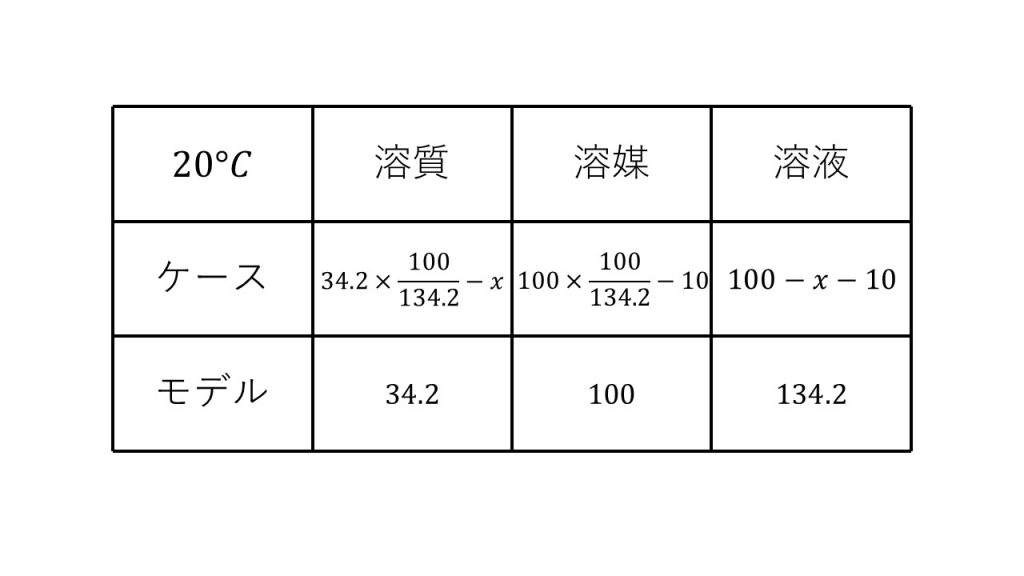
③塩化カリウムの水に対する溶解度は20℃で34.2である。20℃における飽和溶液100gを温度を上げて水10gを蒸発させ、ふたたび温度を20℃まで下げると、何gの塩化カリウムが析出するか。
求める質量をx[g]とする。
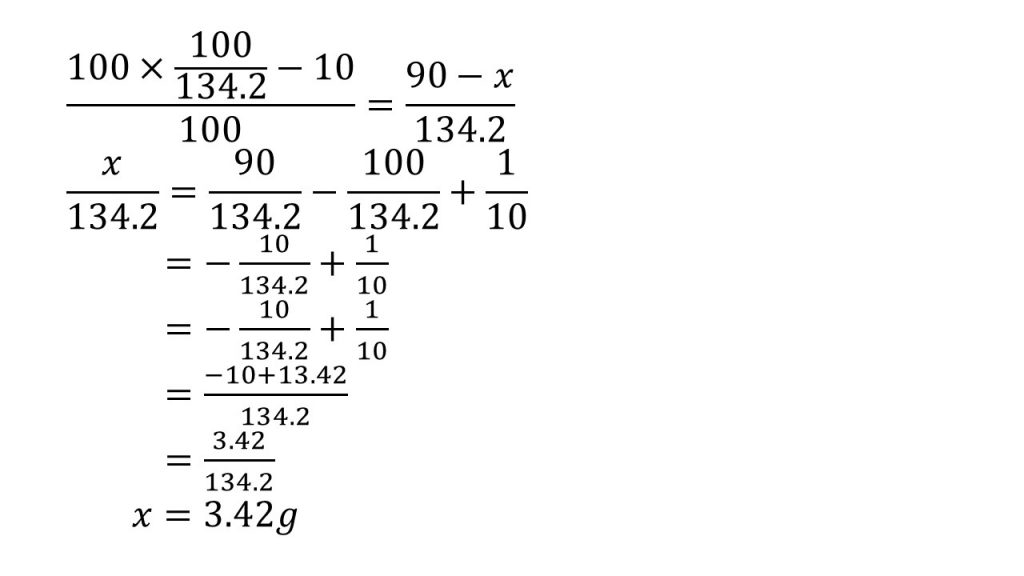
④塩化ナトリウムが混入している硝酸カリウム3000gを水2000gに加え、加熱して完全に溶かした。この水溶液を20℃まで冷却すると、2200gの硝酸カリウムの結晶のみが析出した。混入していた塩化ナトリウムは何gか。20℃における硝酸カリウム、塩化ナトリウムの溶解度は、それぞれ32.0,36.0である。
求める塩化ナトリウムの質量をx[g]とする。
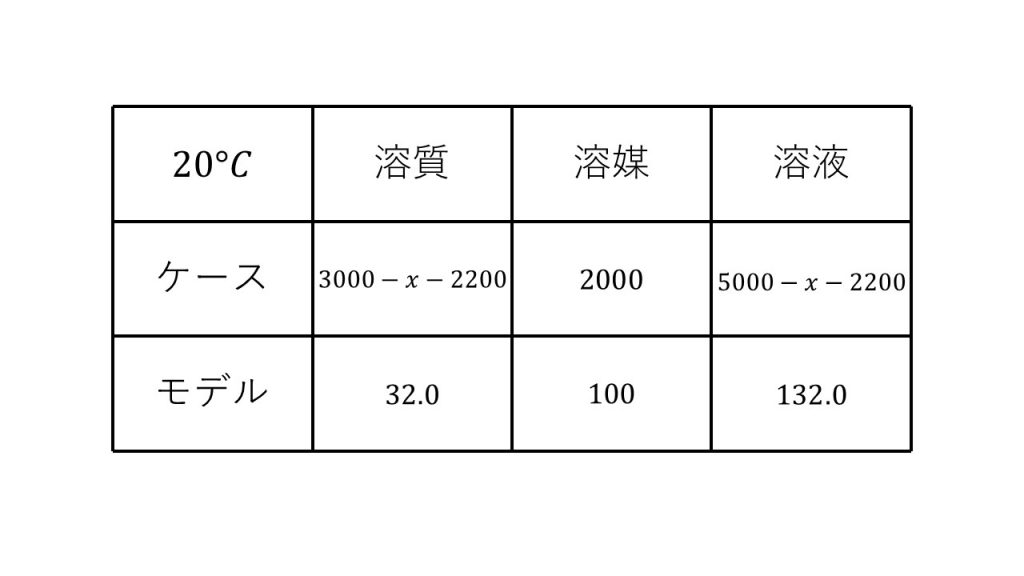
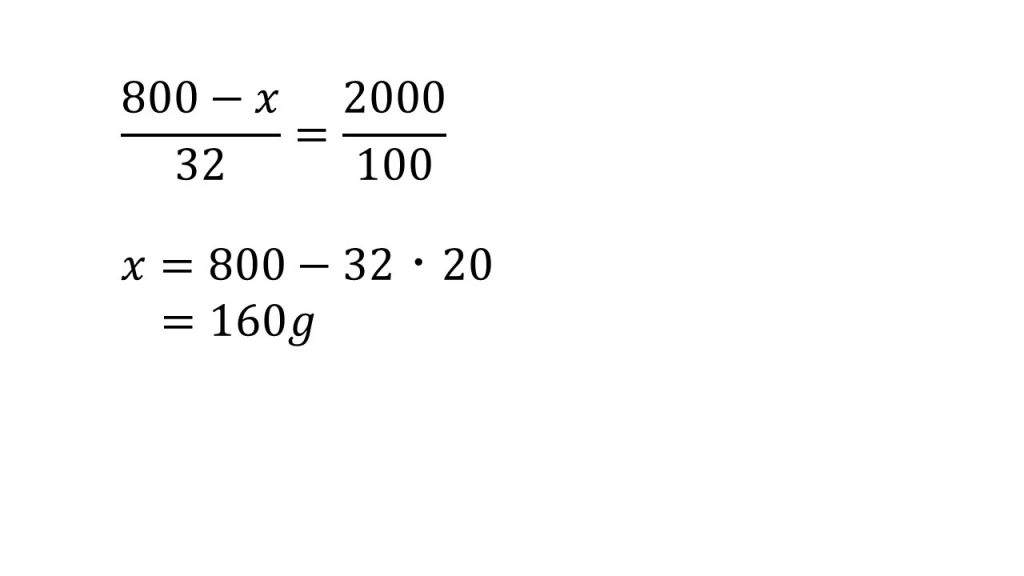
※今回「硝酸カリウムの結晶のみが析出」とあるので、硝酸カリウムの飽和溶液であり、塩化ナトリウムの飽和溶液ではない(塩化ナトリウムは溶解度まで溶けていない)と判断できる。よって、塩化ナトリウムの溶解度は不要な情報である。
⑤硫酸銅(Ⅱ)の溶解度は25℃で23.2である。25℃で硫酸銅(Ⅱ)五水和物の結晶は水100gに最大で何g溶けるか。
求める硫酸銅(Ⅱ)五水和物の結晶の質量をx[g]とする。
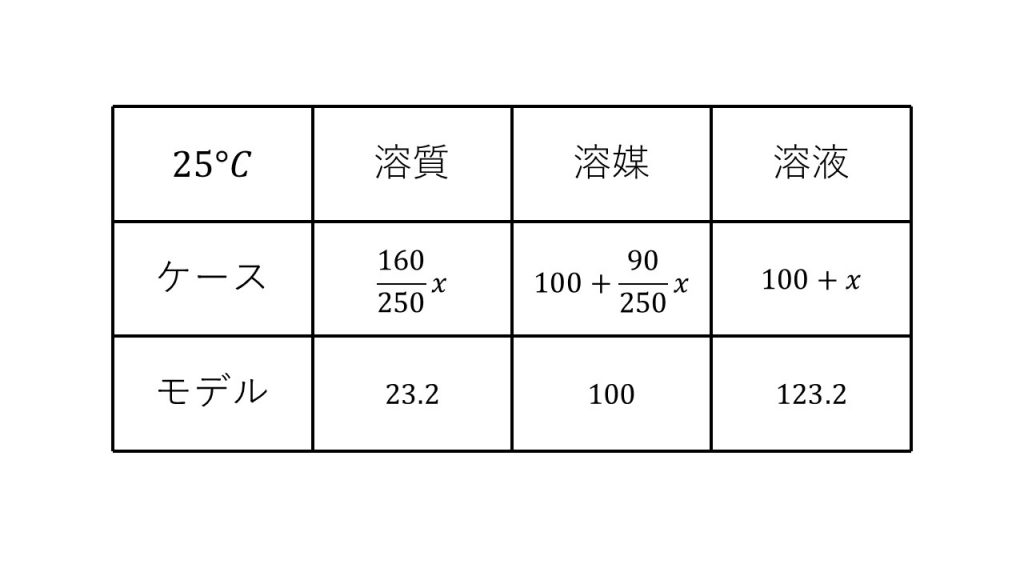
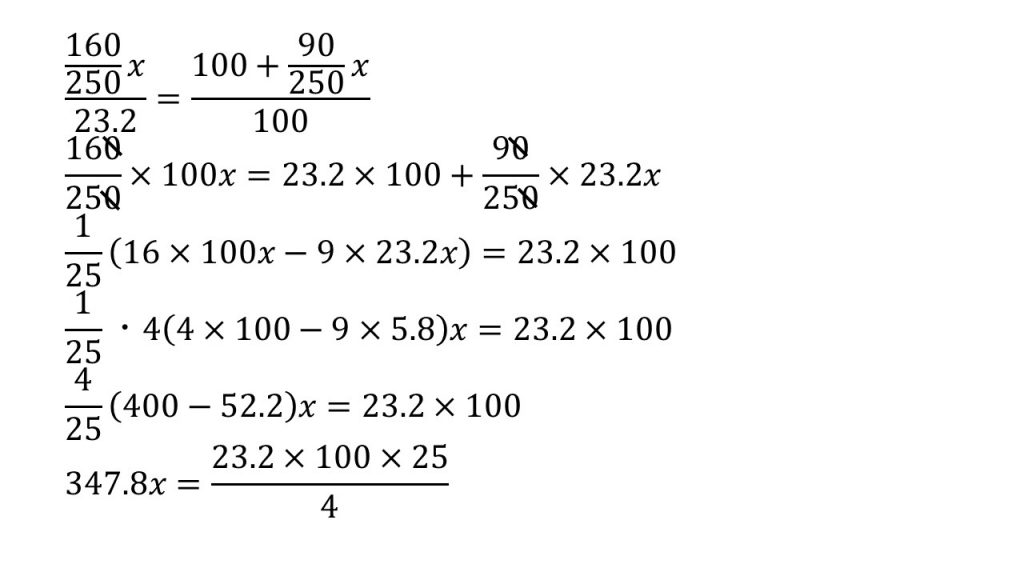

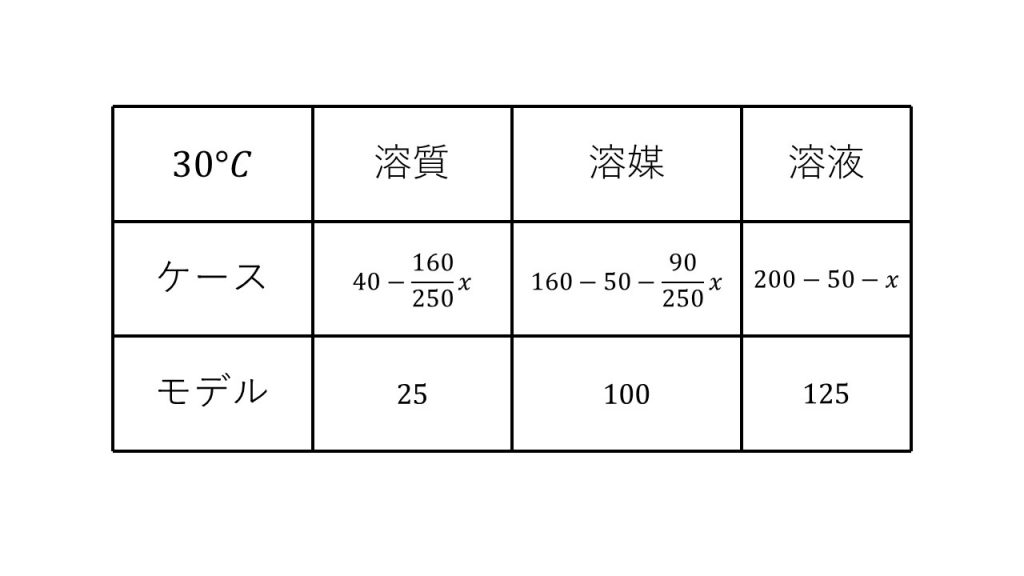
⑥30℃における硫酸銅(Ⅱ)の飽和水溶液200gをとり、水50gを蒸発させた後、再び30℃に戻して放置すると何gの硫酸銅(Ⅱ)五水和物の結晶が析出するか。硫酸銅(Ⅱ)の溶解度は30℃で25である。
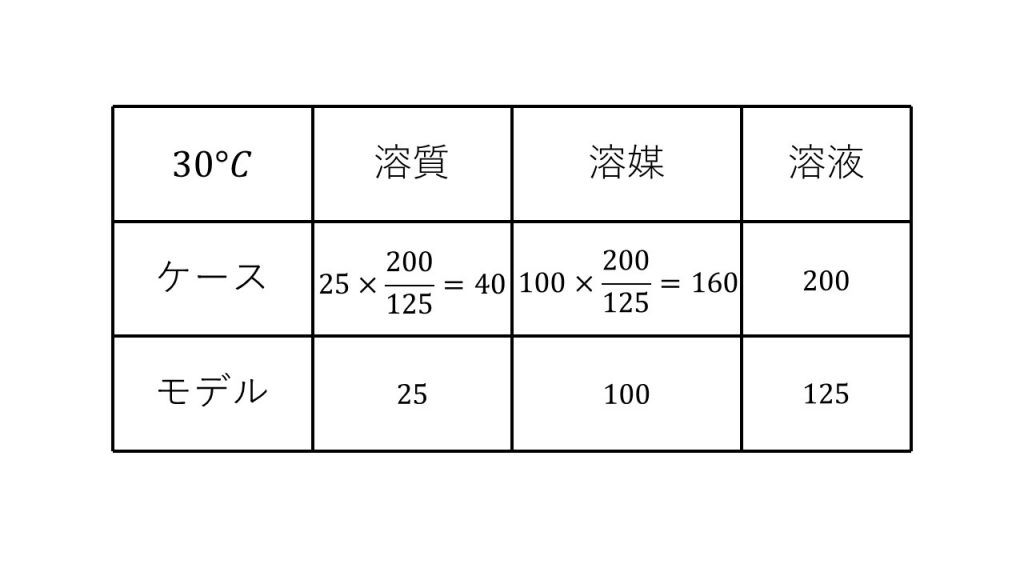
求める硫酸銅(Ⅱ)五水和物の結晶の質量をx[g]とする。

☆問題のみはこちら→溶解度の計算(問題)
【解説授業】
①溶解度の計算の基本(溶質・溶媒・溶液の表を使った計算の方法を解説しています)
②結晶水をもつ固体(硫酸銅(Ⅱ)五水和物)の溶解の計算(硫酸銅(Ⅱ)五水和物の性質についても解説しています)
【その他参考となる解説】
①溶解平衡(溶解度積)の計算(溶解平衡とは何か、溶解度積=一定の導出、沈殿が生じるかどうかの判断の方法についても解説しています)
「化学計算の王道」シリーズは『思考訓練の場としての体系化学』(GHS予備校)を参考にしています。
GHS予備校についてはこちら→https://ghs-yobikou.co.jp/
思考訓練シリーズの購入はこちら→https://ghs-yobikou.shop/
~参考~
☆化学計算の王道(化学基礎)←その他の化学基礎の単元の計算問題と解説
☆化学計算の王道(化学基礎・理論化学) ←理論化学の計算問題と解説はこちら
☆化学の解説動画・授業動画一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識テスト一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学の解説・授業・知識・演習問題一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
