☆問題のみはこちら→モル濃度と質量パーセント濃度の計算(問題)
☆解説授業①:濃度計算の基本(質量パーセント濃度とモル濃度、濃度変換についても解説しています)
☆解説授業②:濃度計算を極めるための3問の解説
※原子量:H=1, C=12, N=14, O=16, Na=23, Cl=35.5, S=32, Cu=64
※以下の問題は全て有効数字2桁で答えよ。
①水酸化ナトリウム16gを水に溶かして2.0Lにしたときの濃度は何mol/Lか。
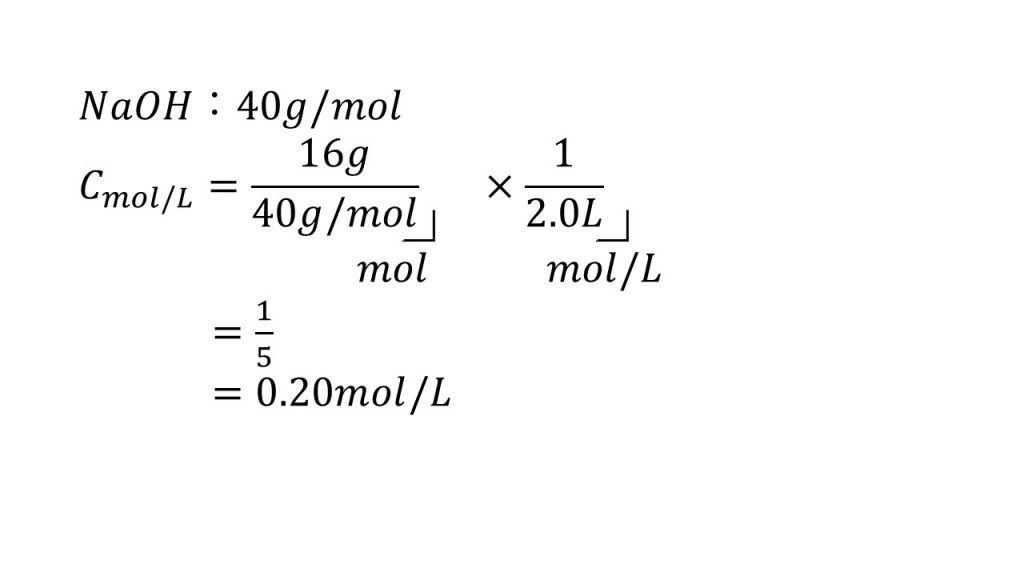
②標準状態で体積が5.6Lの塩化水素を水に溶かして全体を100mLにした。この塩酸の濃度は何mol/Lか。
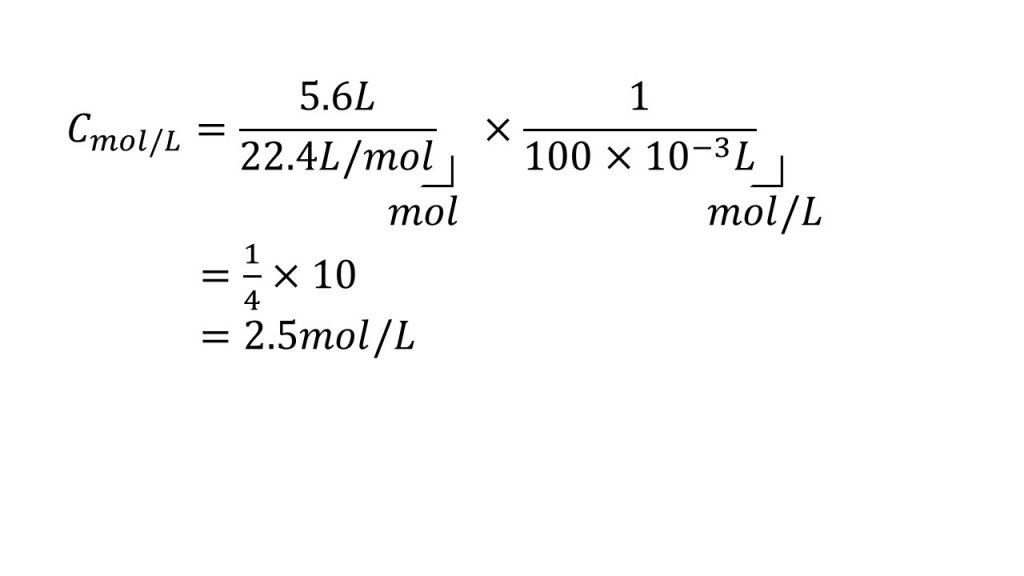
③6.0mol/Lの濃硫酸を水でうすめて、0.30mol/Lの硫酸500mL作るには、濃硫酸が何mL必要か。
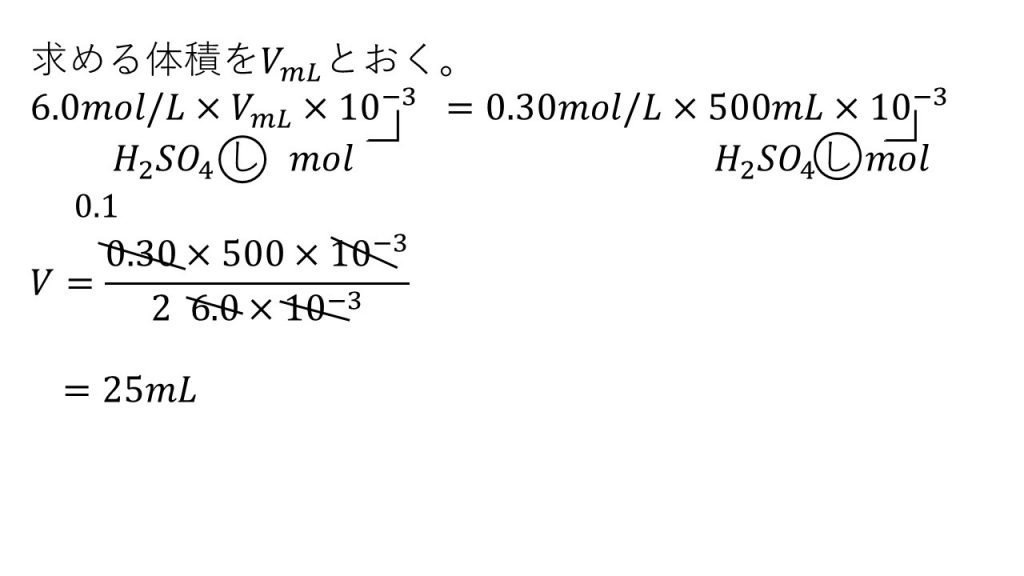
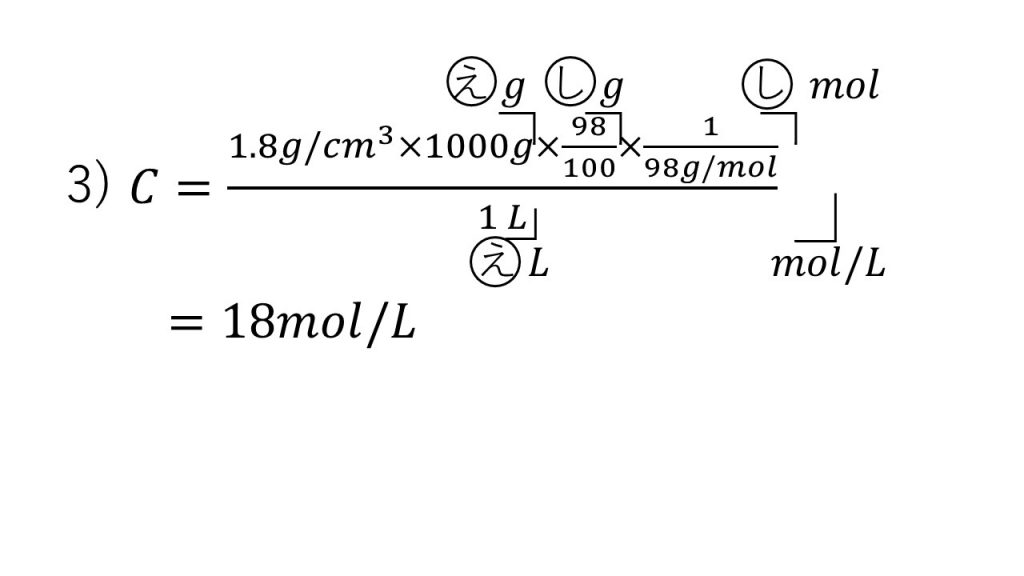
④質量百分率98%、密度1.8g/㎤の濃硫酸について、次の問に答えよ。
1)この濃硫酸1Lの質量は何gか。
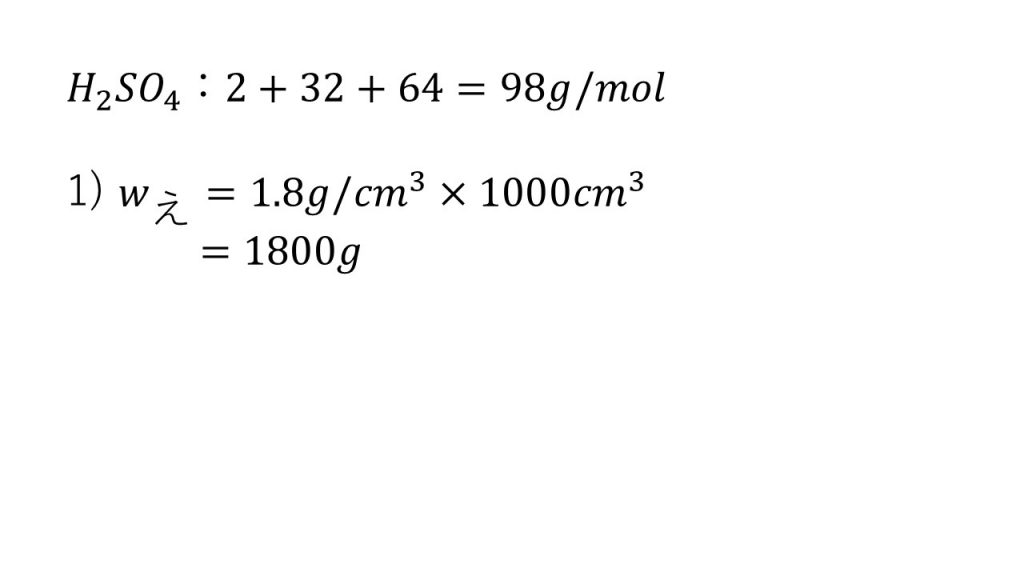
2)この濃硫酸1Lに含まれている溶質は何gか。この問題は四捨五入せず整数で答えよ。

3)この濃硫酸のモル濃度は何mol/Lか。
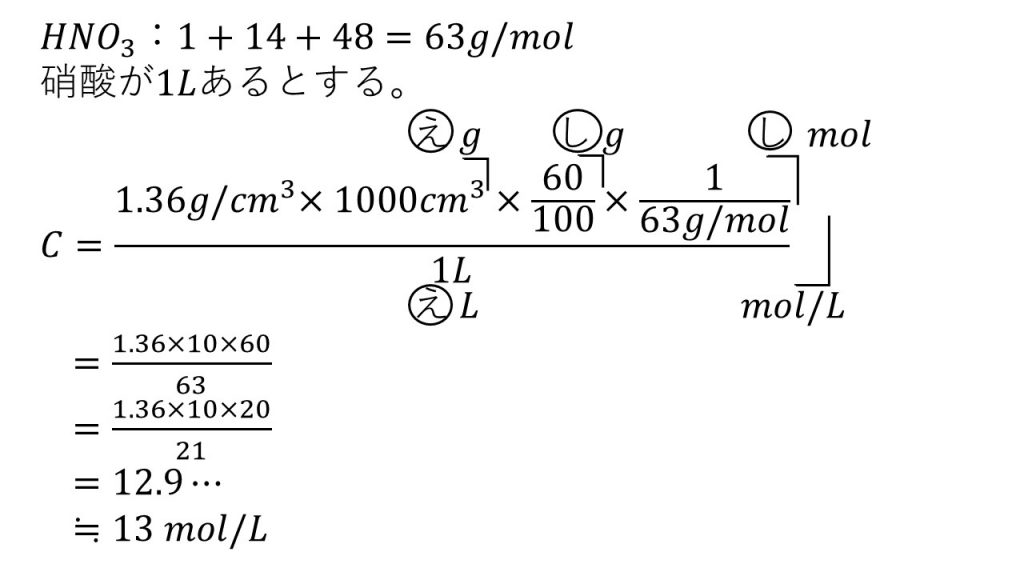
⑤市販の濃硝酸は60%の硝酸の水溶液で、密度が1.36g/㎤である。
1)この硝酸のモル濃度を求めよ。
2)1.0mol/Lの硝酸100mLつくるには、この濃硝酸が何mL必要か。
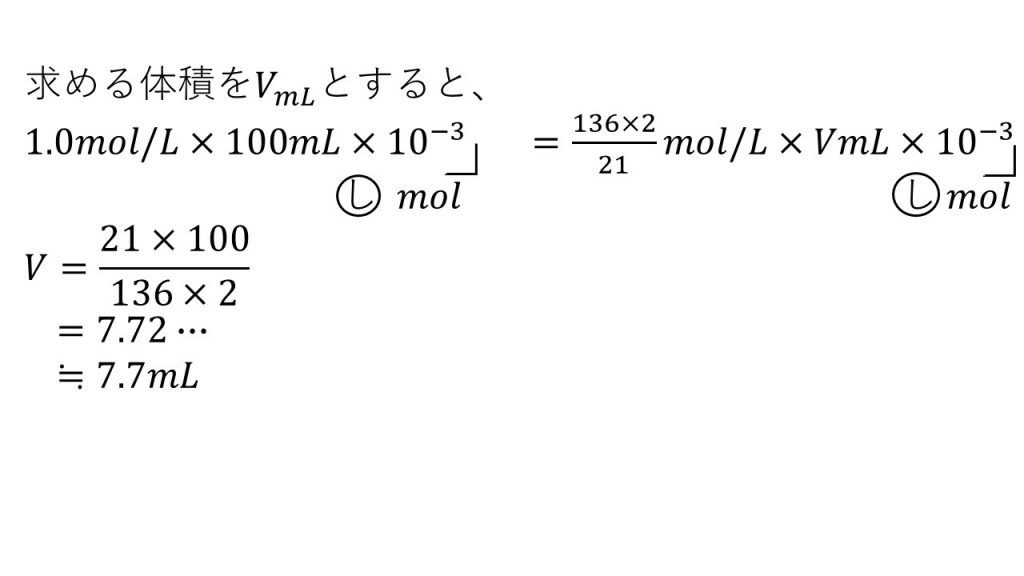
⑥0.20mol/Lの硫酸銅(Ⅱ)水溶液を1L作るには、硫酸銅(Ⅱ)五水和物の結晶が何g必要か。
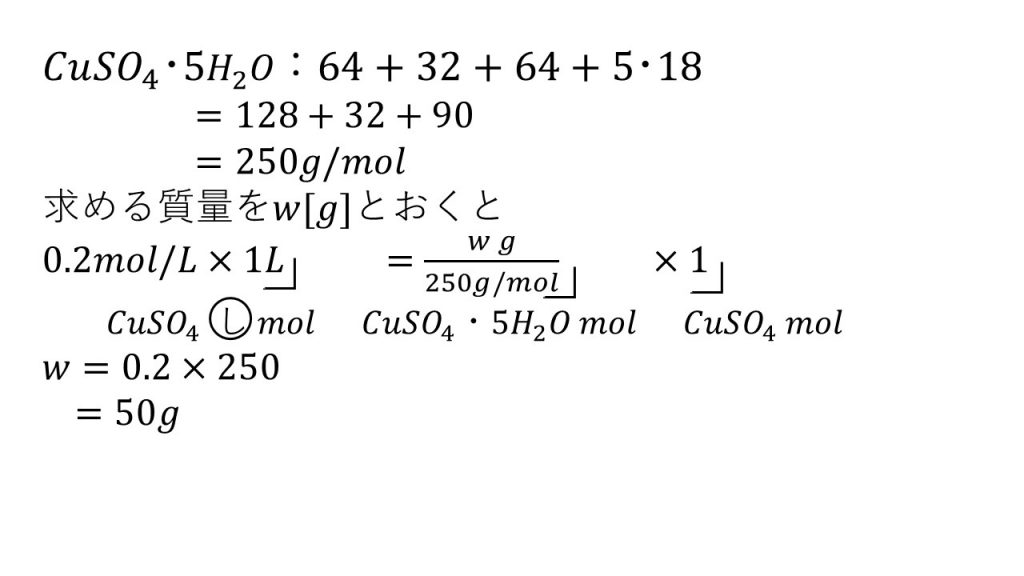
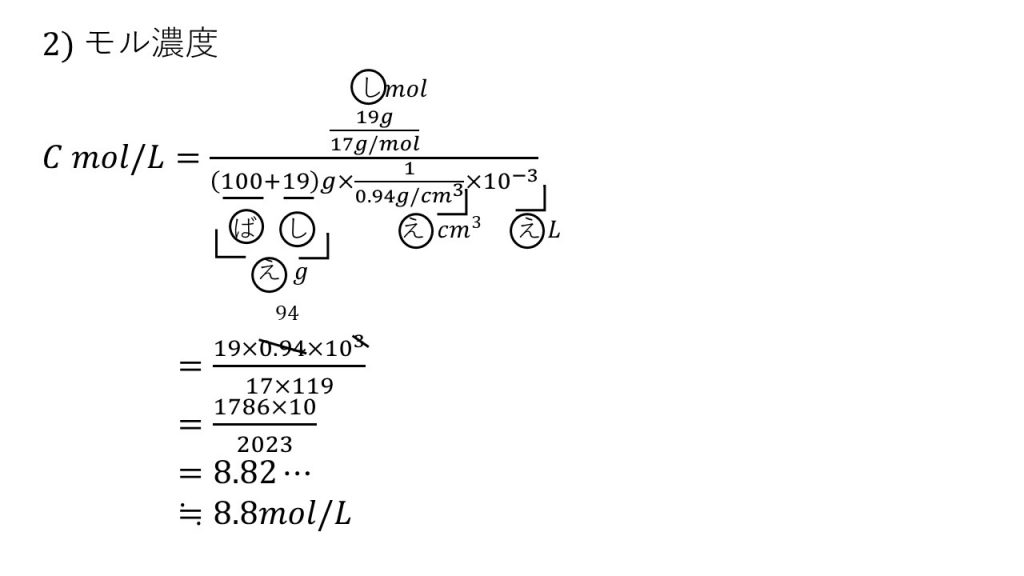
⑦水100mLにアンモニアが19gだけ溶けたアンモニア水の密度は0.94g/㎤である。このアンモニア水の質量パーセント濃度とモル濃度を求めよ。ただし、水の密度は1.0g/㎤とする。

⑧60%の硫酸の密度は1.5g/㎤である。この硫酸50mLに水を加えて50%の硫酸にするには、水を何g加える必要があるか。
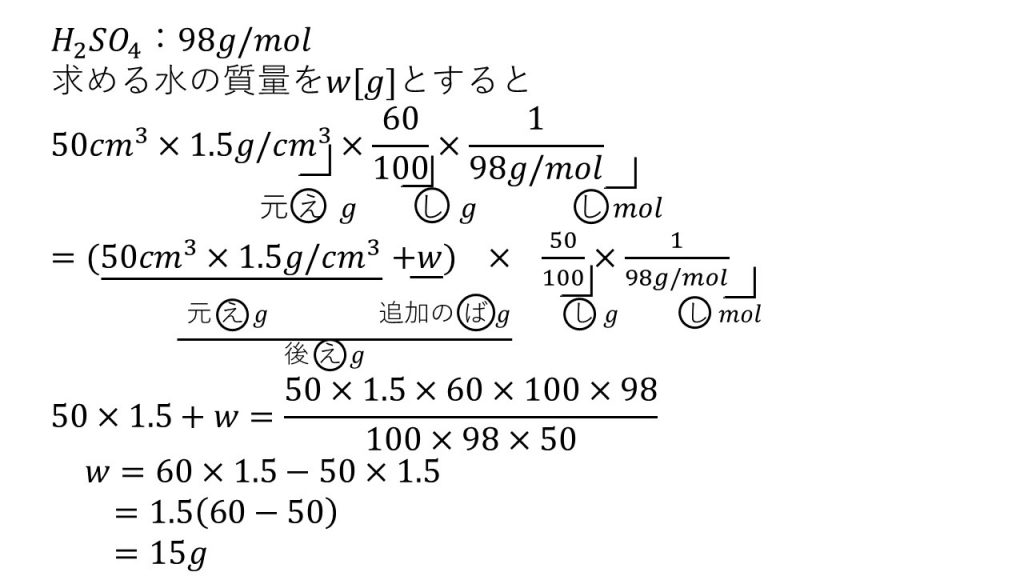
☆問題のみはこちら→モル濃度と質量パーセント濃度の計算(問題)
【解説授業】
①濃度計算の基本(質量パーセント濃度とモル濃度、濃度変換についても解説しています)
「化学計算の王道」シリーズは『思考訓練の場としての体系化学』(GHS予備校)を参考にしています。
GHS予備校についてはこちら→https://ghs-yobikou.co.jp/
思考訓練シリーズの購入はこちら→https://ghs-yobikou.shop/
~参考~
☆化学計算の王道(化学基礎)←その他の化学基礎の単元の計算問題と解説
☆化学計算の王道(化学基礎・理論化学) ←理論化学の計算問題と解説はこちら
☆化学の解説動画・授業動画一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識テスト一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学の解説・授業・知識・演習問題一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
