(1)解説授業動画
☆YouTubeチャンネルの登録をよろしくお願いします→大学受験の王道チャンネル
(2)解説授業の原稿
今回は鉛蓄電池における電解液の濃度変化の問題を解説します。
入試で鉛蓄電池が出題される場合は、最後に電解液の濃度変化を聞かれることがあります。今回の解説を聞いて、そういった問題でも確実に点を取れるようにしましょう。
なお、鉛蓄電池の基本的な考え方や、消費・生成と増減の違いについては理解できているものとして話を進めていきます。もし理解が不十分な場合は、まずそちらの解説をご覧になってください。
溶質の硫酸の消費量と電解液全体の減少量
鉛蓄電池における電解液の濃度変化の問題は、電解液における溶質の硫酸の消費量と、電解液全体の減少量の両方を考える必要があります。
そこでまず、鉛蓄電池の反応をまとめた式を使ってその消費と減少を考えていきます。
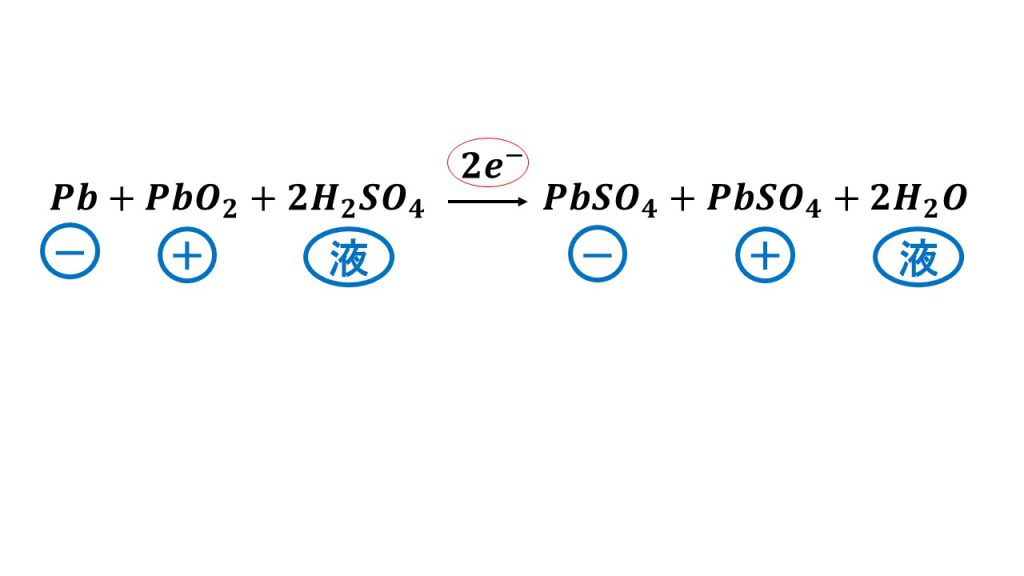
電池や電気分解の反応をまとめた式を書くときは、電子の数を書くようにしましょう。今回は放電を考えています。
つまり鉛蓄電池は、電子を2mol放電するとき、負極では1molの鉛が1mol の硫酸鉛になり、正極では1molの酸化鉛は1mol の硫酸鉛となり、電解液では2molの硫酸が2molの水に変化します。
そのため電解液だけを考えると、電子を2mol放電すると硫酸を2mol分消費するので、溶質は98×2g 減少することになります。
そして溶液全体は、SO3が2mol分減少するので、80×2g 減少することになります。ちなみに溶媒の増減は、濃度を求めるときに使いませんが、水2mol分つまり18×2g分増加することになります。
ポイントは、溶質を考えるときは硫酸の消費量を考えており、溶液を考えるときは電解液の減少量を考えているということです。このように、このタイプの問題は消費と減少を区別して考える必要があります。
鉛蓄電池における電解液の濃度変化の問題の解法の流れ
では、このタイプの問題はどのような流れで解いていけばよいのかというと、
- 放電前の溶質のH2SO4の質量[g]
- 放電による溶質のH2SO4の消費量[g]
- 放電前の溶液の硫酸の質量[g]
- 放電による電解液の減少量[g]
この4つの質量を求めて、

この式を使って放電後の質量パーセント濃度を求めるという流れになります。
この式が意味していることを確認すると、分母は放電前の溶液の硫酸の質量から、電解液の減少量の質量を引くことで、放電後の溶液の硫酸の質量を求めることができます。
そして分子は、放電前の溶質の硫酸の質量から、溶質の硫酸の消費量の質量を引くことで放電後の溶質の硫酸の質量を求めることができます。
あとはこの分数を100倍することで放電後の質量パーセント濃度となります。
それでは実際に、この式を使って鉛蓄電池における電解液の濃度変化の問題を解いてみましょう。
例題
それでは問題を解いていきます。
鉛蓄電池を1.00Aの電流で10時間放電させた。放電前に4.26mol/L の硫酸(密度1.25g/cm3)が250mL 入っていたとすると 、放電後の硫酸の質量パーセント濃度は、何%か求めてみましょう。ただし、原子量はそれぞれ、H=1, O=16, S=32, Pb=207になるとし、有効数字は3桁で答えます。
放電前の溶質の質量と放電前の溶液の質量
まずは放電前の溶質の質量と、放電前の溶液の質量を求めます。
放電前のモル濃度に体積をLにしたものをかけることで、溶質である硫酸の物質量となります。そして、それに硫酸のモル質量をかけることで、溶質である硫酸の質量となります。
また、溶液の密度に溶液の体積をかけることで溶液の質量となります。
放電前の溶質:4.26mol/L×250mL×10-3×98g/mol=104.37g
放電前の溶液:1.25g/㎤×250㎤=312.5g
これで放電前の溶質の質量と、溶液の質量を求めることができました。なお、今回は式が煩雑になっていくので先に計算をしておきます。
消費した溶質の硫酸の質量
それでは次に消費した溶質の硫酸の質量を求めていきます。
求める溶質の硫酸の質量をW質とすると、以下のような方程式を立てることができます。

左辺は、消費した溶質の硫酸の質量を硫酸のモル質量で割ることで、消費した溶質の硫酸の物質量となります。そして化学反応式を見ると、電子を2mol放電するとき、2molの硫酸が消費されているので、消費した硫酸と流れる電子の物質量の比は1:1なので、×1をすることで流れる電子の物質量となります。
そして右辺は、問題文から電気量を求め、それを電子の物質量とします。電流1.00Aに時間を秒にしたものをかけて、電気量つまりクーロンとし、それをファラデー定数で割ることで流れた電子の物質量とします。
あとはこの方程式を解くのですが、今回は計算を省略して、消費した溶質の硫酸の質量は36.55……gとなります。
減少した電解液の質量
さらに減少した電解液の質量を求めていきます。
減少した電解液つまり溶液の質量を W液とすると、以下のような方程式を立てることができます。

電解液の中の硫酸は放電によって水に変化していきます。
化学式で考えると、放電によって硫酸分子から SO3が取れて水分子になっていきます。そのため減少した電解液の質量をSO3のモル質量で割ることで、減少したSO3の物質量となります。
そして反応式を見ると、硫酸と水の係数はともに2なので、電子が2mol流れるときSO3は2mol減少することになります。そのため、電子とSO3の物質量の比は2:2つまり1:1の関係なので、×1をすることで流れた電子の物質量となります。
右辺は先ほどと同様に、問題文から電気量を求め、流れた電子の物質量とします。
あとはこの方程式を解くのですが、計算は省略して、減少した電解液の質量は29.84……gとなります。
4つの質量を使って質量パーセント濃度を求める
これで必要な4つの質量を求めることができたので、あとは質量パーセント濃度を求めていきます。
今回、W質とW液の2つの値を使うときは、有効数字は3桁なので、小数点第2位までで使うようにします。このようにしておけば、計算結果に誤差が生じることはまずないので問題ありません。

分母は放電前の溶液の質量から、放電によって減少した電解液の質量を引くことで、放電後の溶液の質量となります。
そして、分子は放電前の溶質の質量から、放電によって消費される硫酸の質量を引くことで、放電後の溶質の質量となります。
あとはそれを100倍することで23.99となり、有効数字が3桁になるように四捨五入をして、答えは24.0%となります。
いかがだったでしょうか。実際の問題は誘導や小問などがあるので、今回のように4つの質量を何もないところから求めるということはないと思います。しかし4つの質量を求めて、上述の式を使って質量パーセント濃度を求めるという流れを知っておけば、確実に問題が解けるようになります。ぜひ復習しておいてください。
(3)解説授業の内容を復習しよう
(4)電池(理論化学)の解説一覧
①金属のイオン化傾向を完全に理解しよう(水との反応・酸との反応)
②電池の計算の基本(電池が成立するための条件についても解説しています)
③ダニエル電池完全解説(素焼き板の役割、起電力を大きくする方法、電池を長持ちさせる方法)
④鉛蓄電池の計算の考え方(そもそも鉛蓄電池とは何か、充電できる理由、消費・生成と増減の違いについても解説しています)
(5)参考
☆電池と電気分解(理論化学)の解説・授業・知識・演習問題一覧
☆化学の解説動画・授業動画一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識テスト一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学の解説・授業・知識・演習問題一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学の語呂合わせ(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
「化学計算の王道」シリーズは『思考訓練の場としての体系化学』(GHS予備校)を参考にしています。
GHS予備校についてはこちら→https://ghs-yobikou.co.jp/
思考訓練シリーズの購入はこちら→https://ghs-yobikou.shop/
