(1)解説授業動画
☆YouTubeチャンネルの登録をよろしくお願いします→大学受験の王道チャンネル
(2)解説授業の原稿
熱化学方程式のエネルギー図を使った解法
今回は、熱化学方程式の計算を解説します。
熱化学方程式の計算の解法はいくつかありますが、今回はエネルギー図を使った解法をご紹介します。
僕はこの解法が本質的で使いやすいと思うので、この解法をオススメします。ただし、教科書や参考書に書いてある解法とは異なる部分もあるので、その点はご注意ください。
それではエネルギー図を使った解法の流れを解説します。
①エネルギーの基準を決める
まず最初に基準を決めます。
例えば、生成熱の問題なら単体の状態を0とし、結合エネルギーの問題なら原子がバラバラな状態を0とします。このように、まずエネルギーの基準を決めることで、それぞれの物質が持っているエネルギーの値が分かるようになり、計算できるようになるのです、
また、エネルギーにおいて注意したいのは、エネルギーは相対的なものであるということです。つまり、基準の取り方によってその値が変わるということになります。
このことは、物理の位置エネルギーを考えてみると分かりやすいと思います。例えば、床から1mの高さの位置エネルギーは、床を基準とした場合は正の値となりますが、天井を基準とした場合は負の値となります。
このようにエネルギーとは相対的なもので、基準の決め方でその値の大きさや正負が変わってきます。
しかし物質どうしのエネルギーの位置関係、つまり、2つの物質を比べてどちらがどれぐらい高い位置にあるのかといった関係は変わることはないので、その関係を確認するためにもエネルギーの図をかきます。
②左辺と右辺のエネルギーの状態をエネルギー図にかく
まず基準を決めたら次に、左辺つまり反応物のエネルギーの状態と、右辺つまり生成物のエネルギーの状態を図にかきます。
③「反応熱=(左辺のエネルギーの合計)−(右辺のエネルギーの合計)」の方程式を立てる
そしてエネルギー図がかけたら、
反応熱=(左辺のエネルギーの合計)−(右辺のエネルギーの合計)
の関係を使って方程式を立て、問題を解きます。これがエネルギー図を使った解法の流れとなります。
熱化学方程式の問題を解くときに注意すること
また、熱化学方程式の問題を解くときは、次の3つのことに注意しましょう。
①固体・液体・気体の状態を書く
まず1つ目は、状態を書くようにしましょう。
例えば、ある物質が固体なら、その化学式の横に(固)と書きましょう。液体なら(液)、気体なら(気)と書くようにしましょう。
なぜこれを書かないといけないかというと、物質が持っているエネルギーは状態によって変わるからです。
例えば、水の蒸発熱は、だいたい44kJ/molなのですが、それはつまり液体の水よりも気体の水(水蒸気)の方が、1molあたり44kJ分高いエネルギーを持っているということを表しており、左辺を液体の水が持っているエネルギーとして、等式を成り立たせるためには水蒸気の持っているエネルギーから44kJを引かないといけないのです。
H2O(液) = H2O(気)-44kJ
このように同じ物質でも状態によって持っているエネルギーが異なるので、その物質が固体、液体、気体のどの状態なのかを必ず書かないといけません。
なお、毎回漢字を書くのは面倒なので、これからは固体の場合は(s)、液体の場合は(ℓ)、気体の場合は(g)と書くようにします。ちなみにsはsolid、ℓはliquid、gはgasを意味しています。
また、同素体がある元素は、同素体によっても持っているエネルギーが変わるので、どの同素体なのかを書くようにしなければいけません。例えば炭素であれば、黒鉛なのかあるいはダイアモンドなのかは分かるように書かないといけません。
②熱化学方程式の係数に注意する
次の注意点は、係数に注意するということです。
例えば、熱化学方程式に2NH3と書いてあれば、これはNH3の2mol分のエネルギーということなので、「アンモニアの1mol分のエネルギー×2」をしないといけません。
このことは、当たり前のことではあるのですが、意外とこの×2を忘れてしまう人もいるので注意するようにしましょう。
③結合の数に注意する
そして最後の注意点ですが、結合エネルギーを考えるときは結合の数に注意するようにしましょう。
例えば、NH3の結合エネルギーを考えるときは、「NとHの単結合の結合エネルギー×3」しないといけません。なぜ×3になるかというと、NH3は下図のようにNとHの単結合が3つ含まれています。
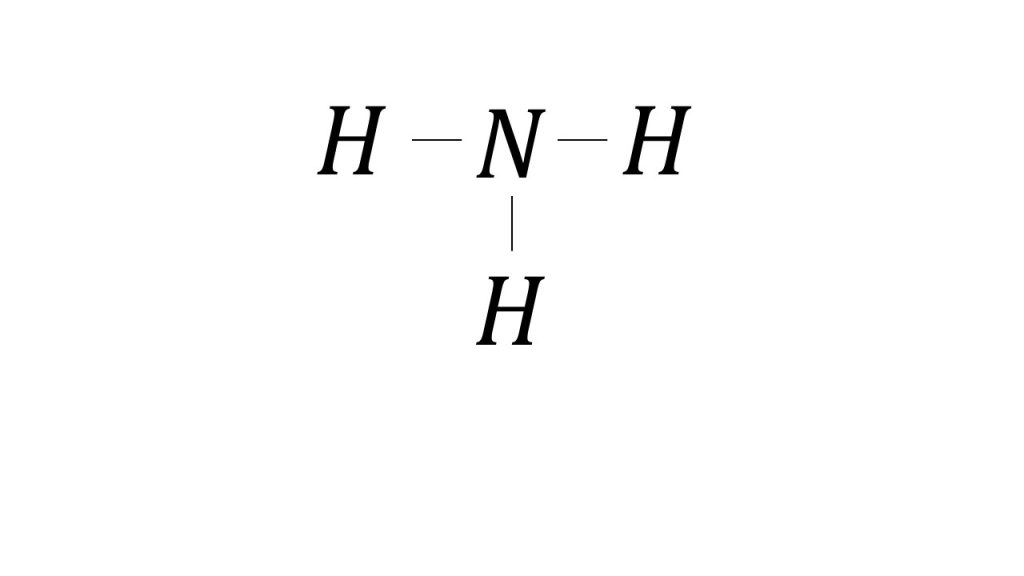
そのためNH3をバラバラの状態にするためには、NとHの結合を3つ切らないといけないので、×3をする必要があるのです。
このように結合エネルギーを考えるときには、1つの分子の中にどれだけの結合が含まれているのかを考えないといけない点に注意しましょう。
ちなみに、このように分子の中に含まれる結合を全て切断し、バラバラの原子の状態にするのに必要なエネルギーのことを解離エネルギーと言います。つまり解離エネルギーは結合エネルギーの合計ということになります。
教科書の解法との違い
以上でエネルギー図を使った解法の流れと問題を解く上で注意すべきことについて確認できたので、これらを使って問題を解いていこうと思います。
ただ、もう1点だけ注意しておきたいことがあり、この
反応熱=(左辺のエネルギー)―(右辺のエネルギーの合計)
の式は教科書や参考書では、おそらく
反応熱=(生成物つまり右辺の生成物の合計)―(反応物つまり左辺の生成物の合計)
あるいは
反応熱=(右辺の結合エネルギーの合計)―(左辺の結合エネルギーの合計)
と書いてあると思います。
基準を決めてエネルギーを考えた場合は、(左辺)―(右辺)なのですが、生成熱あるいは結合エネルギーと考えると、(右辺)―(左辺)となります。つまり、正負が逆になるということです。
ではなぜ正負が逆になるのか、この点も意識しながら問題を解いていきましょう。
生成熱を扱った問題の解法
まずは以下の問題を解きます。
黒鉛および水素の燃焼熱は、394kJ/mol, 286kJ/molである。またメタノールの燃焼熱は726kJ/molである。メタノールの生成熱を求めよ。
黒鉛と水素の燃焼の熱化学方程式を書く
まずは黒鉛と水素の燃焼の熱化学方程式を書いてみます。
燃焼なので酸素と反応させた式を書きます。ただし、化学反応式ではないので→ではなく=とします。
また、黒鉛は黒鉛と分かるようにCの横に(黒鉛)と書きます。それ以外は状態を書くのですが、特に問題に書いていないときは、常温つまり25 ℃, 1大気圧のときの状態を書くようにします。つまり、酸素は常温であれば気体なので気体と書き、二酸化炭素や水素も常温では気体です。そして水は常温では液体なので、液体と書くようにします。
C(黒鉛)+O2(g) = CO2(g)+394kJ
H2(g)+1/2O2(g) = H2O(ℓ)+286kJ
また、もう1つ注意点があり、燃焼熱とは、燃焼させる物質を1mol燃焼させるときに発生する熱量のことなので、燃焼させる物質の係数は必ず1となっていないといけません。その結果、他の物質の係数が分数となっても構いません。
このように何molあたりなのかは、反応熱の種類によって決まっているので、その反応熱が1molと決めているものの係数が1になるように熱化学方程式を書くようにしましょう。ちなみに、生成熱は生成物が1mol生成するときに発生する熱量です。
燃焼熱と生成熱が等しくなるとき
よって、上記の2つの熱化学反応式からあることが分かります。
黒鉛の燃焼によって生成する二酸化炭素の係数が1なので、黒鉛の燃焼熱は二酸化炭素の生成熱と等しくなり、二酸化炭素の生成熱は394kJ/molとなります。
また、水素の燃焼によって生じる水の係数が1なので、水素の燃焼熱と水の生成熱は等しくなります。よって水の生成熱は286 kJ/molとなります。
ただし1点補足しておくと、生成物の係数が1になると必ず生成熱になるというわけではなく、左辺つまり反応物が全て単体となっていないといけません。今回はどちらの式も左辺が単体でかつ生成物の係数が1なので、燃焼熱と生成熱が等しくなったのです。
メタノールの燃焼の熱化学方程式を書く
それでは次に、メタノールの燃焼の熱化学方程式を考えていきます、メタノールの化学式はCH3OHで、常温での状態は液体です。
このようなCとHとOで構成された有機化合物の燃焼の化学反応式を考えるときは、まず、以下のように左辺には酸素を、右辺には二酸化炭素と水を、係数の部分のスペースを空けて書きます。
CH3OH(ℓ)+ O2(g) = CO2(g)+ H2O(ℓ)+726kJ
そして、まず炭素の数をそろえます。今回は左辺の炭素の数が1個なので、二酸化炭素の係数は1です。
次にHの数をそろえます。今回は左辺のHの数が4つで、右辺が2つなので、水の係数を2とします。
CH3OH(ℓ)+ O2(g) = CO2(g)+2H2O(ℓ)+726kJ
そして最後にOの数をそろえます。今、右辺のOは合計4つであり、メタノール自身が1つOを持っていることを考えて、左辺の酸素の係数を3/2とします。先ほども確認した通り、熱化学方程式の場合は係数が分数になっても構いません。
これで両辺の原子の数がそろったので熱化学方程式ができました。
CH3OH(ℓ)+3/2O2(g) = CO2(g)+2H2O(ℓ)+726kJ
このように燃焼の熱化学方程式を考えるときは、酸素を最後に調整すると作りやすくなります。
ここまでは問題文の情報を式にしていきました。ここからこの問題を解いていくのですが、今回求めるものはメタノールの生成熱です。
しかし、メタノールの燃焼の熱化学方程式を見ただけではメタノールの生成熱は分からないので、ここからは先ほど解説したエネルギー図を使った解法でメタノールの生成熱を求めていきます。
エネルギー図をかく
それでは、メタノールのエネルギー図をかいて問題を解いていきます。
その前にもう一度、今までに分かっていることを整理すると、二酸化炭素の生成熱は394 kJ/molで水の生成熱は286 kJ/molです。そしてメタノールの燃焼の熱化学方程式は、
CH3OH(ℓ)+3/2O2(g) = CO2(g)+2H2O(ℓ)+726kJ
このようになっており、今回求めるものは、メタノールの生成熱であるということ、そのため、求めるメタノールの生成熱をQ[kJ/mol]とします。
それではここからエネルギー図をかいていきます。

解法の流れに従って、まずは基準を決めます。
今回は生成熱の問題なので単体が持っているエネルギーを基準とします。つまり今回基準としたエネルギーが0の高さの位置には、黒鉛や水素や酸素といった単体が存在するということになります。
この高さを基準として左辺のエネルギーの状態の位置と、右辺のエネルギーの状態の位置を図にかいていきます。本来は左辺からかいていくのですが、今回は説明のために右辺からかいていきます。
右辺のエネルギーの状態をエネルギー図にかく
右辺つまり二酸化炭素1個と水2個のエネルギーの位置は、ー394+(ー286)×2の位置にあります。
なぜこの位置になるのかを説明します。まず数字は生成熱からきています。例えば二酸化炭素1つだけを考えると、二酸化炭素はー394のエネルギーを持っているということになります。なぜなら二酸化炭素の生成熱が394 kJ/molであるということは、単体の黒鉛と酸素のエネルギーの合計よりも二酸化炭素が持っているエネルギーが394小さいということになるからです。
二酸化炭素が生成する熱化学方程式を見てみるとこのことがより分かりやすくなると思います。
C(黒鉛)+O2(g) = CO2(g)+394kJ
この式が意味することは、単体の黒鉛と酸素のエネルギーの合計は二酸化炭素のエネルギーに394 kJ足したものであるという意味なので、二酸化炭素が持っているエネルギーは、単体の黒鉛と酸素が持っているエネルギーの合計よりも394小さいということになり、二酸化炭素のエネルギーの位置は単体のエネルギーの位置から394だけ低い位置にあるとなるのです。
同様にして水の生成熱は286 kJ/molなので、水のエネルギーの位置は単体の位置よりも286だけ低い位置にあるということになります。
したがって、右辺の二酸化炭素1個と水2個のエネルギーの位置は単体の位置から394だけ下がり、さらに、286×2下がった位置にあるということになるのです。
これで、右辺のエネルギーの位置が図にかけたので、次は左辺のエネルギーの位置を図にかきます。
左辺のエネルギーの状態をエネルギー図にかく
右辺のときと同様の考え方で、左辺のエネルギーの位置も図にかいていきます。
メタノールの生成熱がQだったので、単体の位置からQだけ下がった位置にメタノールのエネルギーの位置があります。
また、O2は単体なので持っているエネルギーは0としています。よって、O2をいくら加えてもQのエネルギーの位置は変化しません。
したがって、ーQの位置が左辺のエネルギーの位置となります。
なお、今回、生成熱は全て正で発熱反応なので単体の位置より下の位置にきましたが、生成熱がマイナスつまり吸熱反応の場合は単体の位置よりも上の位置に来ることもあるので、注意しましょう。
左辺と右辺のエネルギーの差から方程式を立てる
これで左辺と右辺のエネルギーの位置がかけたので、次はその差を考えます。
今回は、反応熱が726 kJだと分かっているので、左辺と右辺のエネルギーの差が726ということになります。
エネルギー図がかけたら、あとは
反応熱=(左辺のエネルギー)ー(右辺のエネルギー)
の方程式を立てます。
今回は反応熱が726 kJなので、
726=(左辺のエネルギー)ー(右辺のエネルギー)
の方程式を立て、この方程式を解くと答えは240 kJ/molとなります。
いかがでしょうか。このようにして熱化学方程式の問題を解くと、確実に問題を解くことができるようになります。
特に注意したいことは、生成熱が正になるとき(発熱反応のとき)は生成物のエネルギーの位置は単体のエネルギーの位置よりも低い位置になるということです。つまり式だけをみると、生成熱にマイナスを付けたものになっているということです。
これがこのやり方と、教科書や参考書に書いてある式の正負が逆になっている理由です。エネルギー図をかいて解く場合は、この点に注意しましょう。
(3)解説授業の内容を復習しよう
(4)熱化学方程式の解説一覧
①熱化学方程式の解法①(エネルギー図を使った解法の解説、生成熱を扱った問題の解法)
②熱化学方程式の解法②(蒸発熱の扱い方、結合エネルギーを扱った問題の解法)
③熱化学方程式の解法③(黒鉛の昇華熱の考え方、熱化学方程式の応用問題)
④気体の燃焼の化学反応式の作り方(酸素の係数は最後に調整する)
(5)参考
☆化学の解説動画・授業動画一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識テスト一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学の解説・授業・知識・演習問題一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学の語呂合わせ(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
「化学計算の王道」シリーズは『思考訓練の場としての体系化学』(GHS予備校)を参考にしています。
GHS予備校についてはこちら→https://ghs-yobikou.co.jp/
思考訓練シリーズの購入はこちら→https://ghs-yobikou.shop/
