(1)解説動画
☆YouTubeチャンネルの登録をよろしくお願いします→大学受験の王道チャンネル
(2)解説授業の原稿
今回はダニエル電池について解説します。
ボルタ電池の問題点
ダニエル電池を理解するためには、まずボルタ電池の問題点を知っておかないといけません。そのため、先にボルタ電池について解説します。
ボルタ電池とは
ボルタ電池は、下図のように電極に亜鉛と銅を使い、電解液に希硫酸を使った電池です。
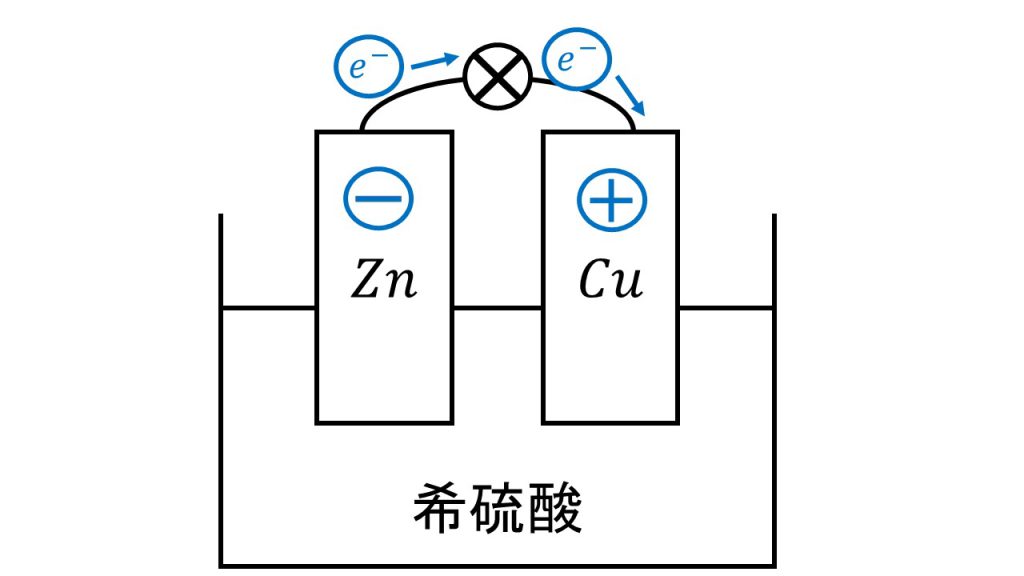
亜鉛と銅のイオン化傾向を比べると亜鉛の方が大きいので、亜鉛が電子を放出し、銅は電子を受け取ります。そのため亜鉛が負極となり、銅は正極となります。
ボルタ電池の負極と正極の反応
ボルタ電池において、負極と正極で以下のような反応が起きています。
負極:Zn → Zn2+ + 2e-
正極:2H+ + e- → H2
負極では亜鉛が酸化されて亜鉛イオンとなり、電子を放出します。そして正極では、水素イオンが還元されて水素となります。
正極で注意したいのは、銅イオンが還元されて銅になるといった反応(Cu2+ + 2e– → Cu)は起きないということです。なぜなら電解液の中に銅イオンは存在しないからです。
電解液は希硫酸であり、硫酸は水溶液中で水素イオンと硫酸イオンに電離(H2SO4 → 2H+ + SO42-)します。そのため正極で還元されるのは水素イオンで、発生するのは水素です。
分極
そしてまさに、この正極で水素が発生するということがボルタ電池の問題点となるのです。
つまり、下図のように正極では水素が気体として発生するわけですが、その水素が正極の周りを覆ってしまい、電気の流れを邪魔してしまうのです。

この現象のことを分極といい、これがボルタ電池の問題点となります。
分極が起きてしまうと、起電力は半分以下にまで下がってしまい、とても使い物になりません。
ダニエル電池は分極が起きない
そこで、なんとか分極が起きないように改良されたのがダニエル電池です。
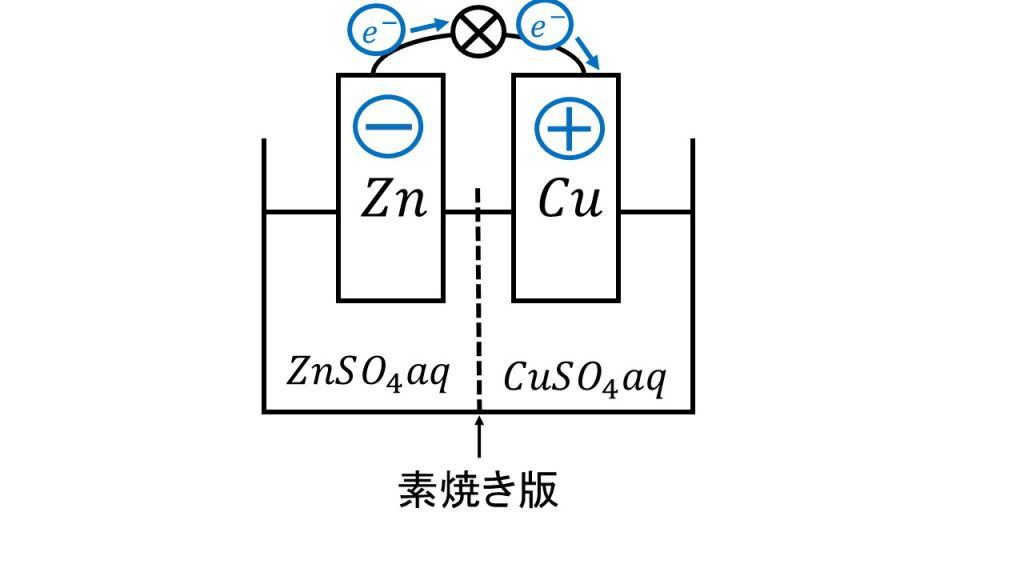
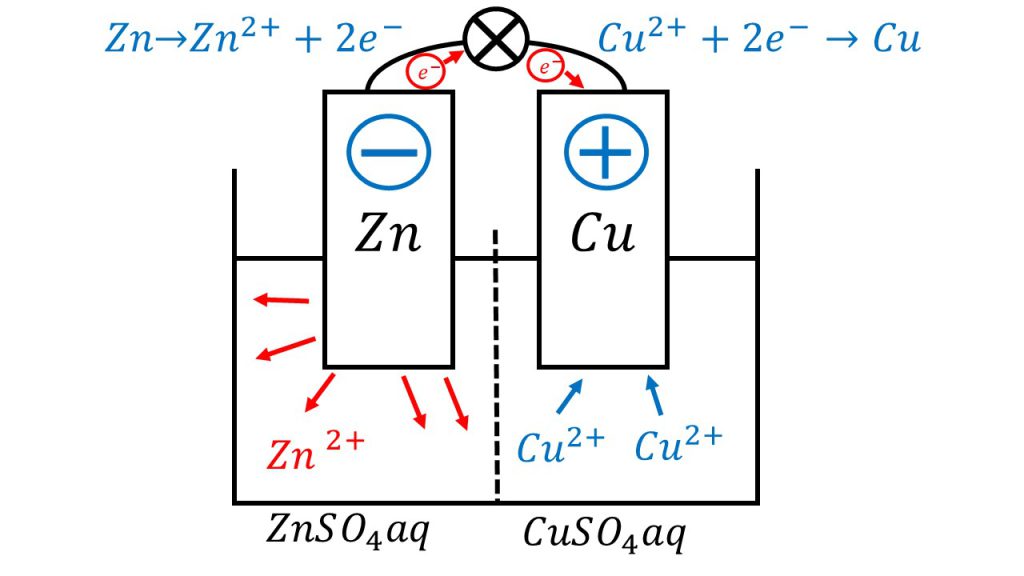
ダニエル電池はこのような電池で、電極を亜鉛と銅にし、電解液を素焼き板で区切って亜鉛側を硫酸亜鉛水溶液、銅側を硫酸銅水溶液とした電池です。ちなみに、この 「aq」は「aqua」の略で、水溶液であるということを表しています。
また、「素焼き」とはただ粘土をこねて焼いただけのもので、植木鉢などが素焼きの代表例です。素焼き板の役割については、この後詳しく解説します。
このようにダニエル電池は電解液に硫酸を使いません。そのため正極で水素が発生しないので、分極が起きないのです。
このようにして、ダニエル電池はボルタ電池の問題点をクリアしたのです。
ポイント①:素焼き板の役割
それではダニエル電池で重要な2つのポイントを解説します。
まず1つ目のポイントは、電解液の仕切りに使っている素焼き板の役割です。
素焼き板の特徴
そもそもなぜ仕切りに素焼き板を使っているのかというと、素焼き板にはたくさんの細孔、つまり小さな穴があるからです。これがダニエル電池において、素焼き板の最も重要な特徴です。たくさんの細孔があればいいので、この仕切りにセロハンなどを使うこともできます。
素焼きの2つの役割
では素焼き板の2つの役割を確認します。1つ目は、電解液を仕切ることによって硫酸亜鉛水容液と硫酸銅水溶液の混合を防ぐことです。
そして2つ目は、たくさんの細孔があるのでイオンは通ることができます。そのため回路が形成されて電池を成立させることができるのです。
電池が成立するためには3つの条件を満たしてないといけません。1つ目は、イオン化傾向の違う金属を電極にすること、2つ目は、電極が電解液に浸されていること、そして3つ目が、回路が形成されているということ、この3つの条件を満たしたとき電池が成立するのです。
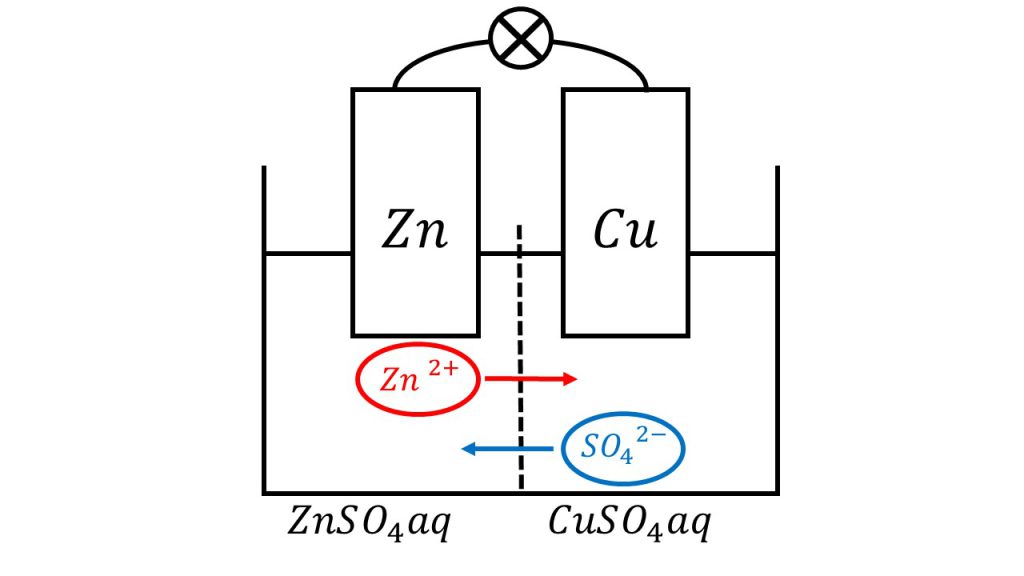
そして素焼き板は両液の混合を防ぎながら、小さな穴がたくさん空いているので、回路を形成することができるのです。例えばガラス板などで仕切ってしまうと、回路が途切れてしまうので、電池が成り立たなくなってしまうのです。
ポイント②:起電力を大きくするために
それでは次のポイントです。次のポイントは、ダニエル電池の問題が出題されたときは、必ず聞かれる問いです。
それは、「起電力を大きくする、あるいは電池を長持ちさせるにはどうすればよいのか」という問いです。
この問いに対する答えは、「硫酸亜鉛水溶液の濃度を小さく、硫酸銅水溶液の濃度を大きくする」となります。
ではなぜこのようにすると起電力が大きくなったり、電池が長持ちするのでしょうか。
ダニエル電池の負極と正極の反応
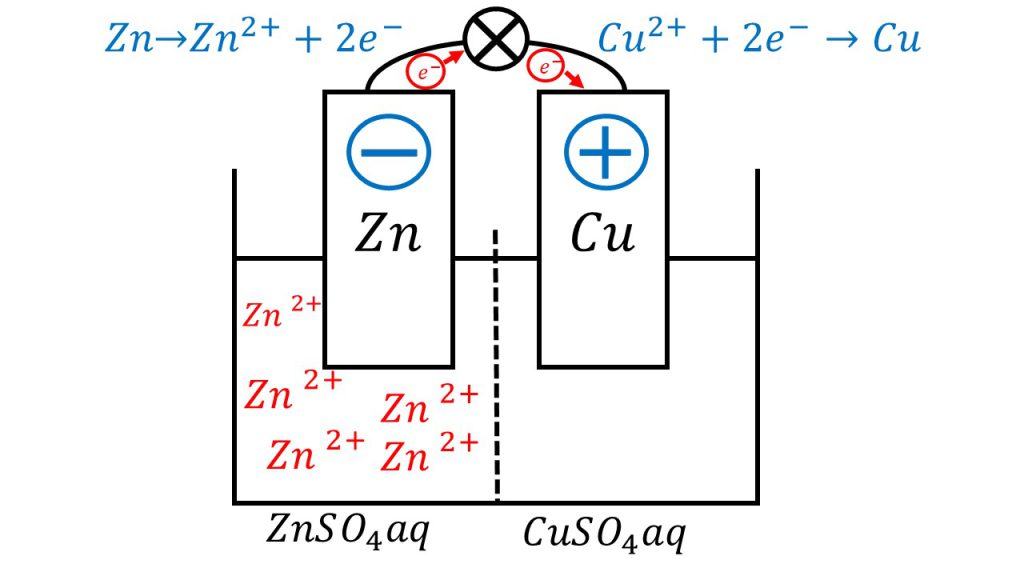
ダニエル電池の負極と正極では、以下のような反応が起きています。
負極:Zn → Zn2+ + 2e-
正極:Cu2+ + 2e- → Cu
負極は亜鉛が酸化されて亜鉛イオンとなり、正極は銅イオンが還元されて銅となります。
そのため、負極側の電解液では亜鉛イオンの量が、どんどん増えていきます。それに対して、正極側の電解液では銅イオンの量がどんどん減っていきます。

硫酸亜鉛水溶液の濃度を小さく、硫酸銅水溶液の濃度を大きくする
このような反応が起きているダニエル電池において、起電力を大きくしたり電池を長持ちさせるためには、これらの反応が起きやすく、かつ長く続くようにしないといけません。
そこで硫酸亜鉛水溶液の濃度を小さくすると、電解液の中に亜鉛イオンの量が少なくなるので、負極から亜鉛イオンが出やすくなり、かつ長く出続けることができます。
また、硫酸銅水溶液の濃度を大きくすると、電解液の中の銅イオンの量が増えるので、この銅イオンの還元反応が起きやすくなり、かつ長くこの反応が続くようになります。
負極のイメージ:「空きスペース」
正極の方はイメージしやすいと思いますが、負極は少しイメージしにくいところがあるかもしれません。そのような場合は「空きスペース」がたくさんあると考えてみてください。
例えば下図のように電解液が亜鉛イオンで満たされていた場合、ここからさらに 亜鉛イオンを電解液に放出しにくいとイメージできると思います。
また、残りスペースがあまりないので、この反応が長く続きにくいというのもイメージできると思います。
そして下図のようにスペースが空けば、亜鉛イオンは出やすくなり、かつ長く出続けることができるようになるということは理解できると思います。
これでダニエル電池における2つの重要なポイントを確認することができました。
なぜ両液は混合してはいけないのか
ここからは少し発展的な内容を解説します。素焼き板の2つの役割をもう少し詳しく解説します。
まず1つ目の役割として「両液の混合を防ぐ」というものがありましたが、そもそもなぜ両液が混合してはいけないのでしょうか。
それは硫酸亜鉛水溶液と硫酸銅水溶液が混ざってしまうと、亜鉛板の上で以下の反応が起きてしまうからです。
Cu2+ + Zn → Cu + Zn2+
例えば下図のように素焼き板を取り除いてしまうと、硫酸銅水溶液の銅イオンが亜鉛板に近づくことができるようになります。

すると亜鉛と銅イオンの間で酸化還元反応、つまり電子のやり取りが起きてしまい、亜鉛から放出される電子が正極ではなく、電解液の方にいってしまいます。すると銅板での還元反応が起きなくなり、電池が成立しなくなるのです。
「回路が形成される」とは
次に素焼き板の役割として「イオンは通すので回路が形成される」というものがありましたが、そもそも「回路が形成される」とはどういうことでしょうか。
「回路が形成している」とは、溶液中で電荷がつり合っている状態を指します。
回路が形成されていない場合
例えば下図のようにガラス板などで電解液を仕切った場合、負極側の電解液では亜鉛イオンが放出されるので、負極側の電解液はプラスの電気を帯びることになります。
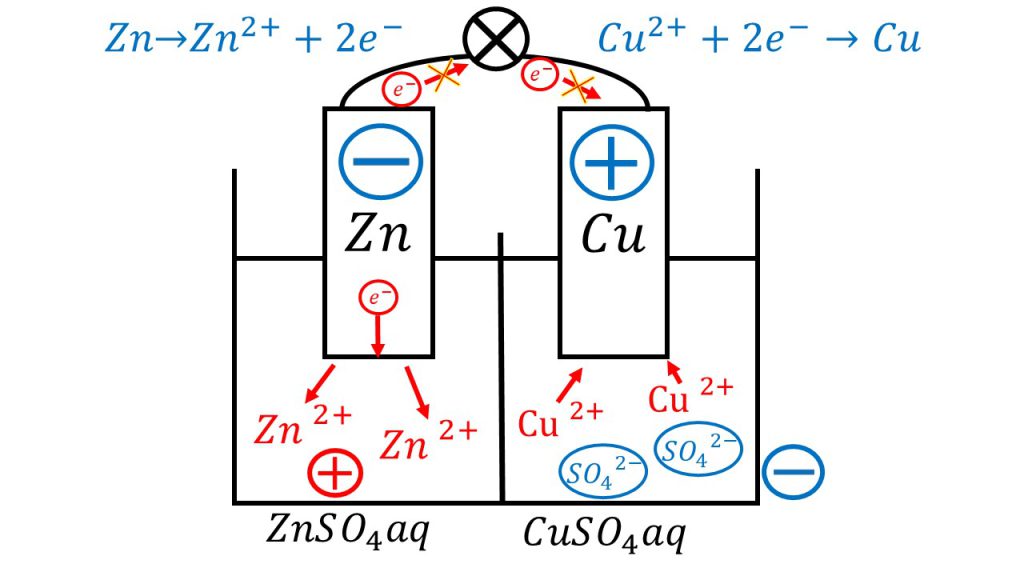
そうなると亜鉛板の電子は電解液側に引きつけられるので、亜鉛板からが移動することができません。
また正極で銅イオンが還元されるので、電解液中の銅イオンの量が減り、硫酸イオンが余るようになります。そうなると、銅板側の電解液はマイナスの電荷を帯びるようになり、電子が銅板の方に近づこうとしても、電子は電解液のマイナスと反発して銅板に近づくことができなくなります。
したがって電解液をガラス板などで仕切ってしまうと電池が成立しなくなってしまうのです。
回路が形成されている場合
そこで素焼き板など、イオンが通ることのできる小さな穴が開いているもので電解液を仕切ると、余った亜鉛イオンが正極側に移動し、余った硫酸イオンが負極側に移動して、それぞれの電解液の電荷がつり合う状態を作ることができるのです。

こうなれば、電子が移動することができ、電池が成立するようになるのです。
いかがだったでしょうか。ダニエル電池を理解すれば電池の原理が理解できるようになります。ぜひ復習するようにしてください。
(3)解説授業の内容を復習しよう
②電池の計算 ←ダニエル電池の計算問題もあります。
(4)電池(理論化学)の解説一覧
①金属のイオン化傾向を完全に理解しよう(水との反応・酸との反応)
②電池の計算の基本(ボルタ電池、電池が成立するための条件についても解説しています)
③ダニエル電池完全解説(ボルタ電池の問題点、素焼き板の役割、起電力を大きくする方法、電池を長持ちさせる方法についても解説しています)
④鉛蓄電池の計算の考え方(そもそも鉛蓄電池とは何か、充電できる理由、消費・生成と増減の違いについても解説しています)
(5)参考
☆電池と電気分解(理論化学)の解説・授業・知識・演習問題一覧
☆化学の解説動画・授業動画一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識テスト一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学の解説・授業・知識・演習問題一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
