(1)解説授業動画
☆YouTubeチャンネルの登録をよろしくお願いします→大学受験の王道チャンネル
(2)解説授業の原稿
緩衝液とは何か? 緩衝作用とは何か?
今回は緩衝液について解説します。
緩衝液とはどのような溶液なのかというと、弱酸とその弱酸の塩を混ぜた溶液、あるいは、弱塩基とその弱塩基の塩を混ぜた溶液のことです。例えば、酢酸と酢酸ナトリウムが溶けている溶液や、アンモニアと塩化アンモニウムが溶けている溶液は、緩衝液となります。
このような緩衝液には緩衝作用というものがあります。緩衝作用とは、酸や塩基を加えてもpHがほぼ一定となる、あるいは、pHが大きく変化しなくなる働きのことです。pHの急激な変化による衝撃を緩める作用ということです。このような緩衝液の緩衝作用は弱酸と弱塩基の性質によって生じます。
では、弱酸と弱塩基の性質がどのようなものであったかを確認します。
弱酸や弱塩基は、電離度が1よりも小さい酸や塩基のことです。特に緩衝液に使われる弱酸や弱塩基は、電離度が0.01や0.02といったように1よりもかなり小さいものです。そして、電離度が1よりも小さいということは、電離する力が弱いということであり、それは見方を変えると、元に戻ろうとする力が強いということになります。元に戻ろうとする力が強いということは、水素イオンや水酸化物イオンとの結びつきが強いとも言えます。このように弱酸と弱塩基は、「弱いけど実は強い」と考えることが緩衝液を理解する上でも重要となります。
ただ、これだけではなぜ緩衝液が緩衝作用を持つのかわからないと思うので、イメージ図を使って説明しようと思います。
緩衝液のイメージ
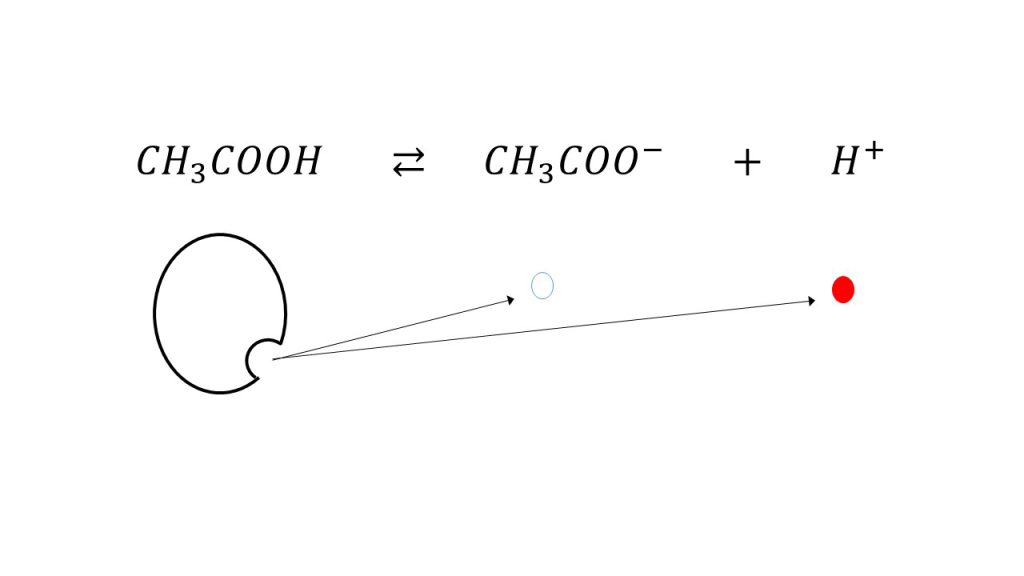
それでは、緩衝液をイメージで考えてみます。まずは弱酸と弱塩基の電離のイメージは、下図のようになります。
例えば酢酸で言えば、酢酸のごく一部が電離して酢酸イオンと水素イオンになります。
そして今回は緩衝液なので、このように酢酸が電離しているところに酢酸ナトリウムを加えます。するとどうなるでしょうか。酢酸ナトリウムは塩なのでほぼ100%酢酸イオンとナトリウムイオンに電離します。すると、下図のように酢酸イオンが追加されます。
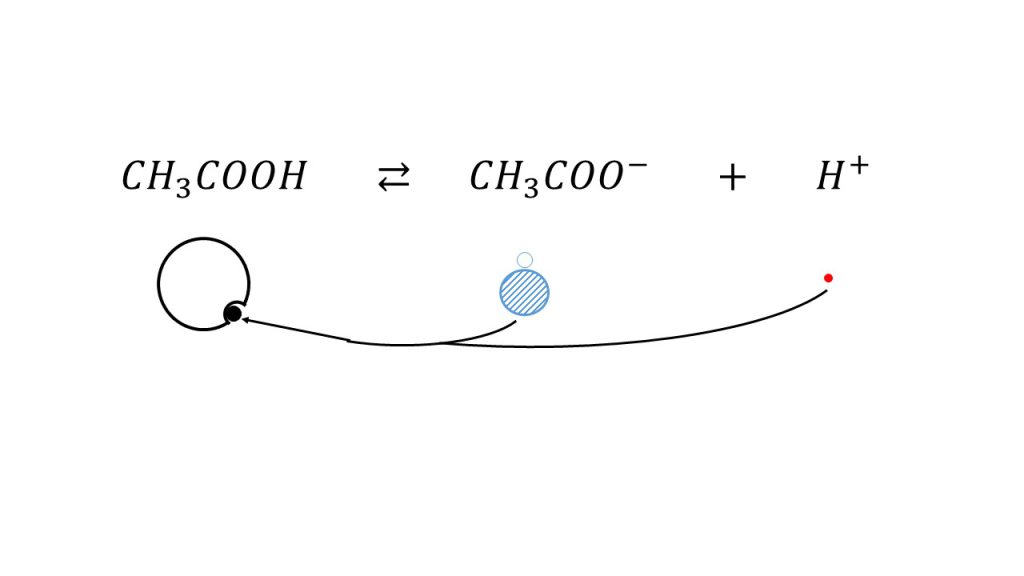
こうなると、酢酸イオンは元に戻ろうとする力つまり水素イオンと結びつこうとする力が強いので、この状態からさらに水素イオンと結びついて元に戻ろうとします。結果として、もともと少なかった水素イオンがさらに少なくなります。
平衡という観点で考えると、酢酸イオンの量を増やしたので、酢酸イオンの量を減らそうとして平衡が左へ移動したということになります。これが緩衝液の状態です。
緩衝作用のイメージ
それではこの状態の緩衝液に酸や塩基を加えるとどうなるか確認していきます。
緩衝液に酸を加える
まずは酸を加えます。
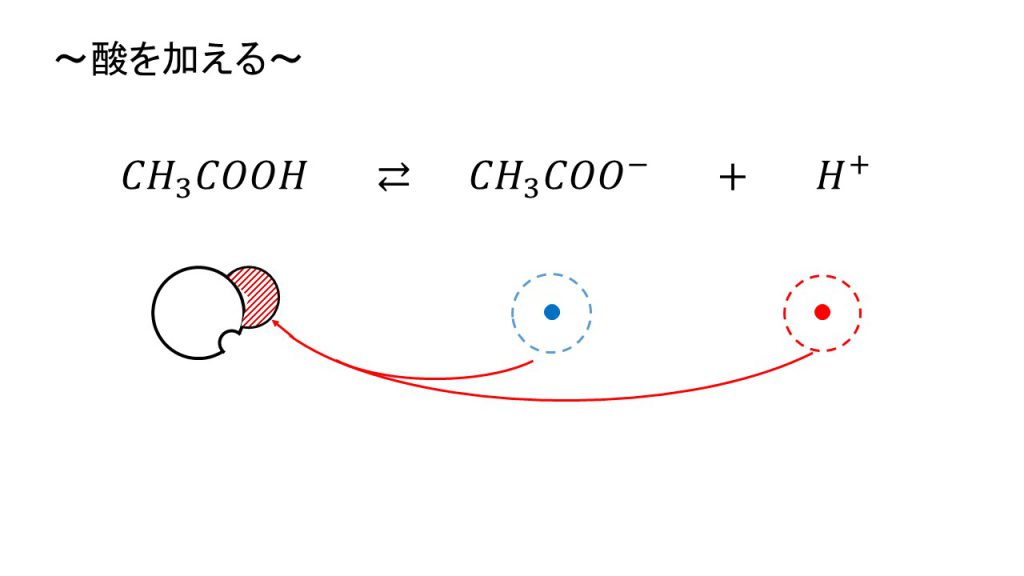
酸を加えると、水素イオンが追加されます。このままだと急激にpHが変化してしましますが、緩衝液には酢酸イオンがいます。酢酸イオンは水素イオンとの結びつきが強いので、追加された水素イオンと結びついて酢酸に戻ります。
そのため、追加された水素イオンを酢酸イオンが捕まえていくので、結果として水素イオンはそこまで増加しなくなります。水素イオンがあまり増加しないということは、つまりpHの変化を和らげる緩衝作用があるということになります。
平衡で考えてみると、水素イオンの量が増えたので、それだけ平衡が左に移動したということになります。
緩衝液に塩基を加える
次に塩基を加えます。
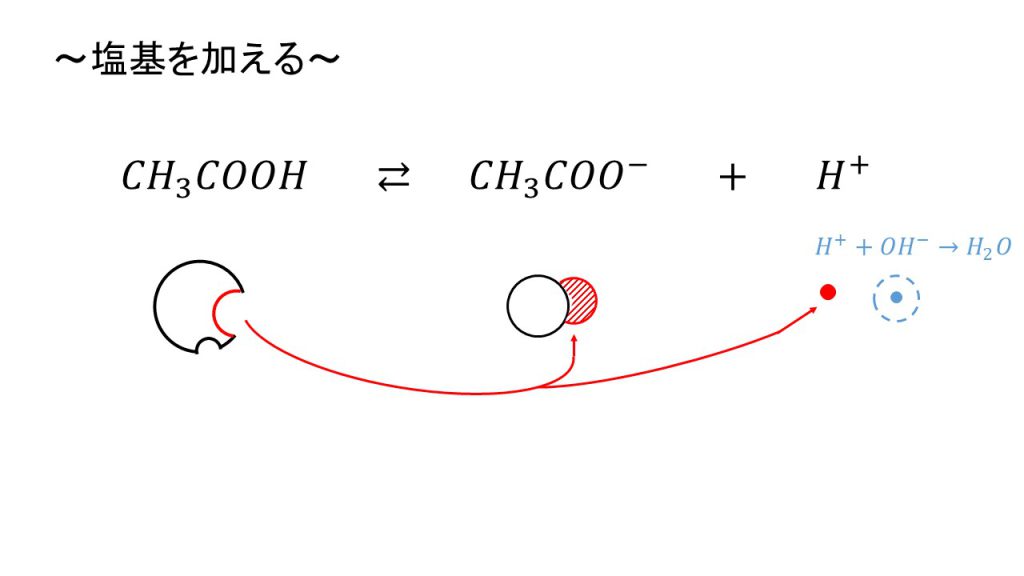
塩基を加えるということは水酸化物イオンを加えるということになります、この状態の溶液に水酸化物イオンを加えると、水酸化物イオンは水素イオンと結びついて、H++OHー→ H2Oのように、水になろうとします。
しかし、この電離平衡となっている状態から、水素イオンが0になるということはありません。なぜなら水素イオンが減ったとしても、平衡を保つために酢酸が電離するからです。
もちろん新たに電離してきた水素イオンも水酸化物イオンが捕まえて水となってしまいます。しかし、そうなってもまた新たな水素イオンが電離してきます。そして、それを繰り返していくと、結果として水酸化物イオンがほとんど無くなるまで酢酸の電離は続き、水素イオンの変化量は小さくなります。
したがってpHはあまり変化しないので、塩基を加えた場合も緩衝作用が働いたということになります。
この場合を平衡で考えてみると、水素イオンの量が減ったので、水素イオンの量を増やそうとして平衡が右へ移動したということになります。
これが緩衝液のイメージです。このように考えるとなぜ緩衝作用が働くのかが理解しやすくなると思います。
また、この2つの現象について補足しておきます。弱酸のイオンを含む水溶液に強酸などを加えて水素イオンを与えると弱酸に戻ります。この現象のことを弱酸遊離と言います。また酸を含む水溶液に塩基を加えることで、塩と水が生成する反応のことを中和といいます。つまり、緩衝作用は弱酸遊離と中和という現象が起きることによって働いているとも考えることができます。
このことを踏まえて、緩衝液の計算の方針を確認します。
緩衝液の計算問題の方針
それでは、緩衝液の計算問題の方針を確認します。緩衝液の計算問題を確実に解くときの鍵は「順番に処理する」ということです。
①まず弱酸遊離や中和といった反応を先に処理します。このときのポイントは、弱酸や弱塩基の電離は考えずに処理するということです。つまり弱酸や弱塩基の電離は起きていないものとして、弱酸遊離や中和といった反応を考えます。
②そして、弱酸遊離や中和といった反応が全て終わったあとで、残ったもので電離平衡を考えます。
このように順番に処理することが重要になります。もちろん実際にこの2つの現象は、同時に起きています。しかし2つの現象を同時に考えるのは非常に困難なので、分けて順番に考えるようにしましょう。
また、考える順番は、強い反応を先にして弱い反応を後にすると考えやすくなります。
それでは、この考え方を使って実際に問題を解いてみます→緩衝液②(緩衝液の計算、緩衝液に酸を加えたときのpHの計算)
(3)解説授業の内容を復習しよう
(4)電離平衡の解説一覧
①電離平衡の基本(弱酸・弱塩基の電離度とpHを求めます。近似についても解説しています)
②電離平衡で考える塩の加水分解(「塩の加水分解は存在しない」と言える理由、計算の進め方、水のイオン積についても解説しています)
③緩衝液①(緩衝液とは何か、緩衝液のイメージ、緩衝液の計算方針について解説しています)
④緩衝液②(緩衝液の計算、緩衝液に酸を加えたときのpHの計算)
(5)参考
☆化学の解説動画・授業動画一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識テスト一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学の解説・授業・知識・演習問題一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学の語呂合わせ(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
「化学計算の王道」シリーズは『思考訓練の場としての体系化学』(GHS予備校)を参考にしています。
GHS予備校についてはこちら→https://ghs-yobikou.co.jp/
思考訓練シリーズの購入はこちら→https://ghs-yobikou.shop/
