(1)解説授業動画
☆YouTubeチャンネルの登録をよろしくお願いします→大学受験の王道チャンネル
(2)解説授業の原稿
蒸発熱の扱い方
それでは次はこの問題を解きます。
二酸化炭素、液体の水、エタノールの生成熱はそれぞれ394 kJ/mol、286 kJ/mol、277 kJ/molである。また、水の蒸発熱は44KJ/molである。このとき、
C2H5OH(ℓ)+3O2(g)=2CO2(g)+3H2O(g)+QKJ
のQの値を求めましょう。
この熱化学方程式は、エタノールの燃焼の熱化学方程式ではありません。なぜなら水が気体になっているからです。この点に注意して問題を解いていきましょう。
ちなみに生成熱を使った生成の熱化学方程式や、状態変化の熱化学方程式は書く必要はありません。なぜなら生成熱や蒸発熱という言葉の意味が理解できていれば、わざわざ熱化学方程式を書かなくてもエネルギー図をかくことができるからです。
それでは答案を作っていきます。
エネルギー図をかく
まずはエネルギーの基準を決めます。今回は生成熱を扱う問題なので、単体の持つエネルギーを基準とします。つまり、黒鉛や酸素や水素といった単体は0の位置にあるとします。
そして、左辺と右辺のエネルギーの位置をエネルギー図にかいていきます。

まずは左辺のエネルギーの位置を図にかきます。
エタノールの生成熱は+277なので、単体のエネルギーの位置よりもエタノールのエネルギーの位置は、277低い位置にきます。そして酸素は単体であり、エネルギーを0としたので、いくら加えてもエネルギーの位置が変化することはありません。これで左辺のエネルギーの位置を図にかくことができました。
続いて右辺のエネルギーの位置を考えていきます。
ただし、今回は気体の水(水蒸気)の生成熱は与えられておらず、液体の水の生成熱しか与えられていません。そのため、生成熱から直接右辺のエネルギーの位置を考えることができないので、まずは気体の二酸化炭素2つと液体の水3つのエネルギーの位置を図にかきます。
すると、二酸化炭素の生成熱が394なので、394×2つ分エネルギーが下がり、その位置からさらに286×3下がった位置が、二酸化炭素2つと液体の水3つのエネルギーの位置となります。
ただ、これでは水の状態が、与えられている熱化学方程式とは違うので、この差がQとはなりません。
気体の水(水蒸気)のエネルギーの位置
次に考えるのは、この液体の水を全て気体にしたときエネルギーの位置がどう動くのかを考えます。
この3つの液体の水を3つとも全て気体にした場合、エネルギーの位置は液体のときよりも44×3だけ高い位置にきます。
なぜ44×3だけ高い位置にくるのかというと、水が水蒸気になるときの熱化学方程式が、
H2O(ℓ)=H2O(g)ー44KJ
となるからです。つまり液体の水と気体の水(水蒸気)を比べてみると、1molあたり44kJだけ気体の水の方が液体の水よりも高いエネルギーを持っているということをこの熱化学方程式は表しているのです。
そのため、液体の水を気体の水に変えた場合、1つあたり44だけ高い位置にくるので、3つあれば44×3高い位置にくることになります。
水に限らず、液体の状態と気体の状態を比べると基本的に気体の状態の方がエネルギーが高くなります。それはなぜかというと、気体というのは分子がバラバラになっている状態であり、そのバラバラの状態を保つためには高いエネルギーが必要だからです。化学においては、基本的にくっついている状態よりもバラバラの状態の方がエネルギーが高くなるということは知っておきましょう。
左辺と右辺のエネルギーの差を考える
これで、左辺(C2H5OH(ℓ)+3O2(g))と右辺(2CO2(g)+3H2O(g)+QKJ)のエネルギーの状態が図にかけたので、あとはその差を考えます。
つまり左辺のエネルギーの位置と右辺のエネルギーの位置の差が今回求める反応熱となります。なぜならC2H5OH(ℓ)+3O2(g)=2CO2(g)+3H2O(g)+QKJの式から分かる通り、右辺の物質のエネルギーの状態にQを足すことで左辺のエネルギーの状態となるからです。
それでは、図が完成したので、
Q=ー277ー{(ー394)×2+(ー286)×3+44×3}
の方程式を立てて、この方程式を解くと、答えはQ=1237となります。
このように状態によってエネルギーの位置が変わるので、状態変化による熱の出入りも考えながらエネルギー図をかくようにしましょう。
結合エネルギーを扱った問題の解法
それでは次にこの問題を解いていきます。
H―H、O=O、O―Hの結合エネルギーは、それぞれ432 kJ/mol、494 kJ/mol、459 kJ/molである。このとき水蒸気の生成熱を求めてみましょう。
この問題は結合エネルギーを扱った問題です。結合エネルギーとは、気体分子内の共有結合を1mol切断するのに必要なエネルギーのことです。
このような結合エネルギーを扱った問題でも、生成熱の問題と同様に解くことができます。では、答案を作っていきます。
水蒸気の生成の熱化学方程式を書く
まずは、求める生成熱をQ(kJ/mol)として水蒸気の生成の熱化学方程式
H2(g)+1/2O2(g)=H2O(g)+QkJ
を書きます。今回は生成熱で解く問題ではないので、生成の熱化学方程式は書く必要があります。
原子がバラバラの状態を基準にする
そして、エネルギー図をかくためにエネルギーの基準を決めます。
結合エネルギーの問題の場合は、原子がバラバラの状態をエネルギーの基準(0kJ)とします。
原子がバラバラの状態とは、水素原子や酸素原子が他の原子とはくっつかずにそのままの状態でいることができるエネルギーの状態です。このような状態はとても不自然な状態なので、この状態のエネルギーはとても高い位置にあります。
そのため、原子がバラバラの状態を基準とした場合、分子や化合物といったもののエネルギーの状態は必ず基準よりも低い位置にきます。
そのため、結合エネルギーがマイナスとなることはありません。生成熱の場合は、マイナスとなって基準よりも高い位置にくることはありますが、結合エネルギーに関してはそのようなことは絶対にありません。この点が生成熱と結合エネルギーの異なる点です。
エネルギー図をかく
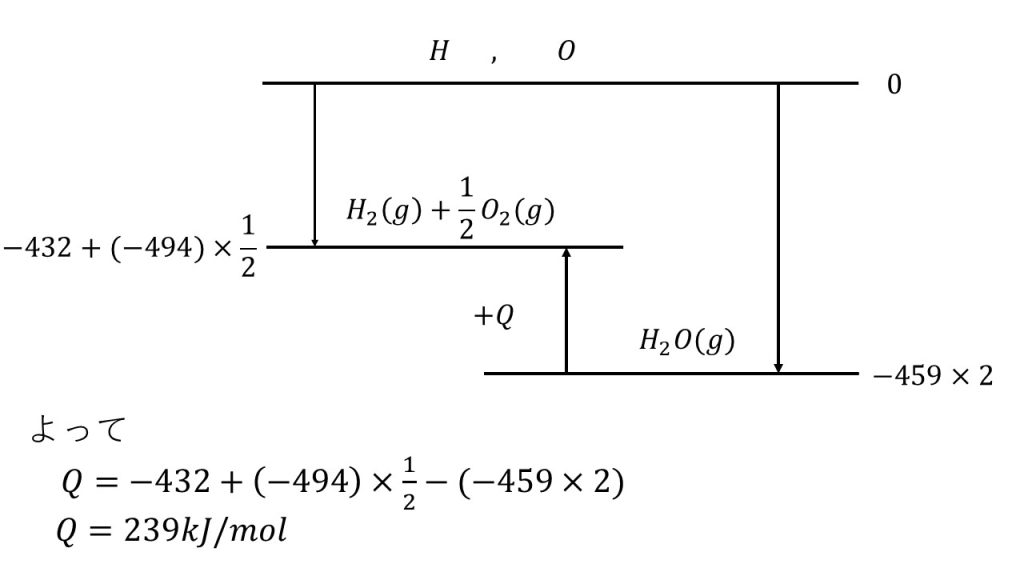
それでは、左辺(H2(g)+1/2O2(g))のエネルギーの状態を図にかいていきます。左辺つまり水素分子1個と酸素分子1/2個のエネルギーの位置は、上図の位置になります。
水素分子はHとHの単結合で、酸素分子はOとOの二重結合です。これらの結合を切断して、原子がバラバラの状態になるためには結合エネルギーが必要であるということは、バラバラの状態に比べて、これらが結合している状態のエネルギーの位置は低い位置にくるということになります。
Hがバラバラの状態から1molのH2を結合させるとエネルギーが432下がり、さらにOがバラバラの状態からOを二重結合でつないだものを1/2個作るためには、494×1/2エネルギーを下げることになります。
これで左辺のエネルギーの状態を図にかけたので、次は右辺(H2O(g)+QkJ)のエネルギーの状態を図にかいていきます。
H2O(g)は、OとHの単結合の結合エネルギー×2の分だけバラバラの状態からエネルギー下げます。
なぜ×2になるのかというと、H2Oの構造がH―O―Hのようになっているからです。つまり、H2O1molに対してOとHの単結合は2mol存在するので、バラバラの状態に比べるとOとHの結合エネルギーの2mol分下げた位置がH2Oのエネルギーの位置となるのです。
左辺と右辺のエネルギーの差から方程式を立てる
これで左辺と右辺のエネルギーの位置が図で確認でき、この差がQであると分かります。したがって、
Q=ー432+(ー494)×1/2ー{(ー459)×2}
の方程式を立てることができ、この方程式を解いて答えはQ=239 kJ/molとなります。
このように結合エネルギーの問題でも、エネルギーの基準を取り、エネルギー図をかいて、方程式を立てて解くことができると分かりました。
ただし1点だけ注意したいことがあります。それは、結合エネルギーは気体分子の結合を切断するのに必要なエネルギーであるということです。
そのため結合エネルギーを使ってH2Oのエネルギーの位置を考えるときは、そのH2Oは気体でなければいけません。もし液体の水の場合は、蒸発熱などを使ってエネルギーの位置を考えなければいけないことに注意しましょう。
(3)解説授業の内容を復習しよう
(4)熱化学方程式の解説一覧
①熱化学方程式の解法①(エネルギー図を使った解法の解説、生成熱を扱った問題の解法)
②熱化学方程式の解法②(蒸発熱の扱い方、結合エネルギーを扱った問題の解法)
③熱化学方程式の解法③(黒鉛の昇華熱の考え方、熱化学方程式の応用問題)
④気体の燃焼の化学反応式の作り方(酸素の係数は最後に調整する)
(5)参考
☆化学の解説動画・授業動画一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識テスト一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学の解説・授業・知識・演習問題一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学の語呂合わせ(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
「化学計算の王道」シリーズは『思考訓練の場としての体系化学』(GHS予備校)を参考にしています。
GHS予備校についてはこちら→https://ghs-yobikou.co.jp/
思考訓練シリーズの購入はこちら→https://ghs-yobikou.shop/
