☆問題のみはこちら→気体の状態方程式を使った計算(問題)
☆解説授業①:理想気体の状態方程式の使い方(理想気体とは何か、混合気体の考え方、計算の工夫の仕方についても解説しています)
☆解説授業②:混合気体の計算の基本(全圧・分圧の考え方、ドルトンの分圧の法則についても解説しています)
※原子量:H=1, C=12, N=14, O=16
※圧力単位:1atm=1.0×105Pa=760mmHg
※気体定数:R=8.3×103〔Pa・L/K・mol〕
※以下の問題に出てくる気体は全て理想気体であるとする。
※②以外は有効数字2桁で答えよ。
①容積5.0Lの容器に1.0×105Paの空気を7.5L詰めると、同じ温度で容器内の圧力は何Paになるか。

②0℃, 2.0×105Paで、120mLの気体を熱して、同じ2.0×105Paで200mLにするには、何℃まで加熱すればよいか。有効数字3桁で答えよ。
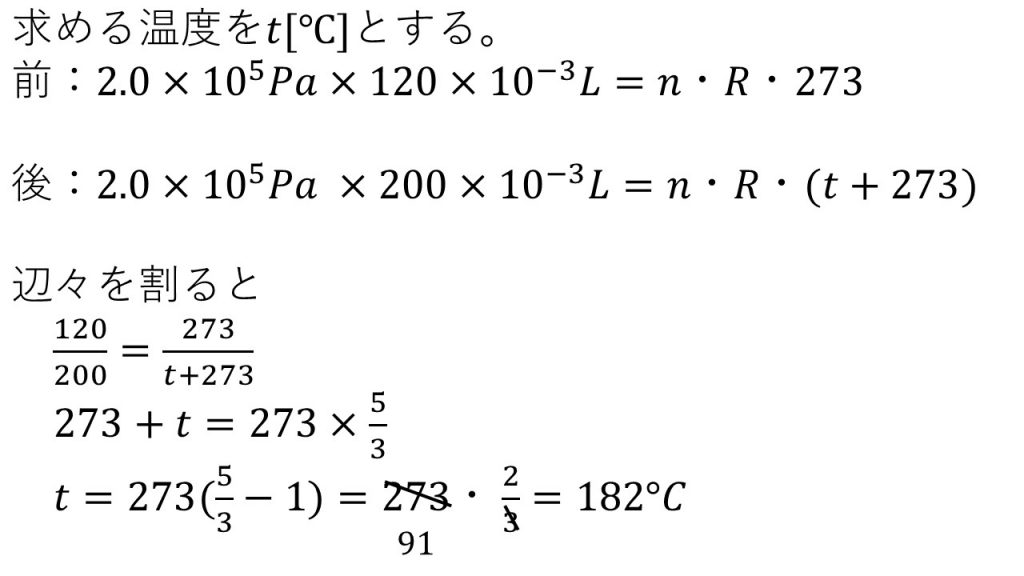
③ある気体の体積を測定したら、27℃, 950hPaで7.5Lであった。この気体は0℃, 1.0×105Paでは、何Lを占めるか。また、何molに相当するか。

④1.0Lの液体のベンゼン(分子量78)を加熱して蒸気にすると、その体積は1.0×105Pa, 100℃のもとで何Lを占めるか。ただし、ベンゼンの密度は25℃で0.88g/mLとする。

⑤47℃, 912mmHgで、8.19gの体積が5.60Lになる気体の分子量を求めよ。

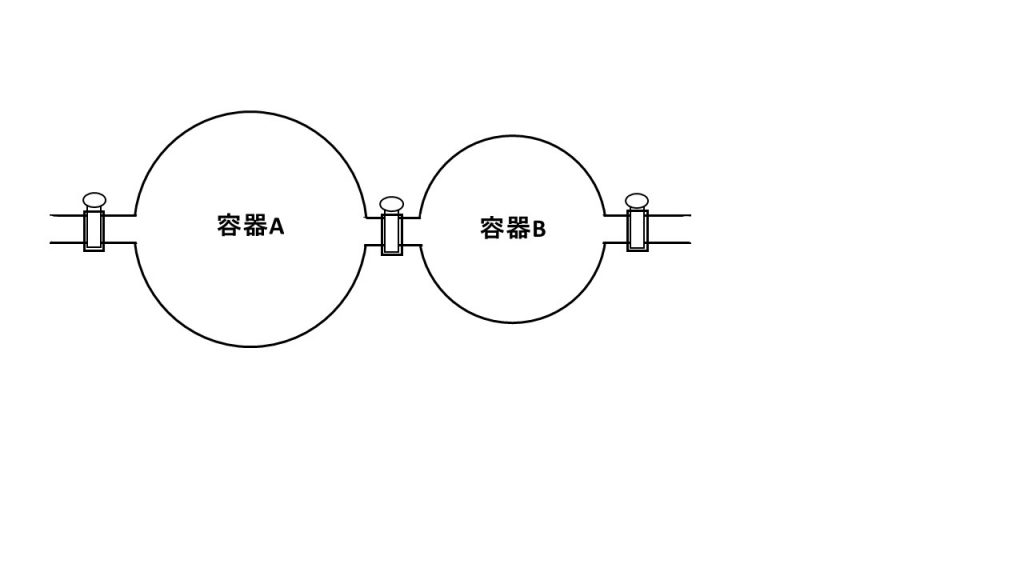
⑥60℃で、容積4.0Lの容器Aに11.2gの窒素が入っており、また、容積2.0Lの容器Bに9.6gの酸素が入っている。コックを開け、60℃に保ったまま十分長い間放置したとき、全圧は何Paになるか。また、窒素の分圧は何Paか。

☆問題のみはこちら→気体の状態方程式を使った計算(問題)
【解説授業】
①理想気体の状態方程式の使い方(理想気体とは何か、混合気体の考え方、計算の工夫の仕方についても解説しています)
②混合気体の計算の基本(全圧・分圧の考え方、ドルトンの分圧の法則についても解説しています)
【その他参考となる解説】
②圧平衡定数の計算の解説(気体の平衡を考えるために必要なものについても解説しています)
③気体の燃焼(閉鎖系)の計算(気液平衡とは何か、飽和蒸気圧の使い方、液体が存在するかどうかの判断の方法についても解説しています)
「化学計算の王道」シリーズは『思考訓練の場としての体系化学』(GHS予備校)を参考にしています。
GHS予備校についてはこちら→https://ghs-yobikou.co.jp/
思考訓練シリーズの購入はこちら→https://ghs-yobikou.shop/
~参考~
☆化学計算の王道(化学基礎・理論化学) ←その他の単元の計算問題と解説はこちら
☆化学の解説動画・授業動画一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識テスト一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学の解説・授業・知識・演習問題一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
