(1)解説授業動画
☆YouTubeチャンネルの登録をよろしくお願いします→大学受験の王道チャンネル
(2)解説授業の原稿
2種類の気体の燃焼の問題
今回は閉鎖系の気体の燃焼の解説をします。
気体の燃焼の問題は開放系の閉鎖系の2つの種類があります。開放系とは、大気中で気体を燃焼させることです。それに対して閉鎖系とは、容積の決まっている密閉容器の中で気体を燃焼させることです。
開放系の場合、大気中なので空気(酸素)は無限にあるものとして考えることができるため、燃焼反応は過不足なく完全に反応が進行します。
それに対して閉鎖系は、容積を変えることのできない密閉容器の中で燃焼させるため、すべて反応しない気体が存在することになります。また、液体が存在する場合は飽和蒸気圧を考える必要もあります。そのため、一般的には開放系よりも閉鎖系の問題の方がややこしくなりがちです。
今回は閉鎖系の気体の燃焼の解説をします。なお開放系の気体の燃焼の解説は、別の動画で解説しているのでぜひそちらもご覧になってください。
- 気体の燃焼(開放系)の計算(化学反応式を使った計算の仕方、燃焼の化学反応式の作り方についても解説しています)
- 気体の燃焼(開放系)の計算の応用問題(複雑に見える問題でも1つの方程式にすることができます)
飽和蒸気圧・気液平衡とは何か?
それでは閉鎖系の気体の燃焼の解法の方針を確認したいのですが、その前にまず飽和蒸気圧とは何かについて確認します。
飽和蒸気圧とは、気液平衡となっているときの気体の圧力のことです。そのため飽和蒸気圧を理解するためには、気液平衡とは何かについて理解しておかないといけません。
気液平衡とは、液体から気体に蒸発する分子数と、気体から液体に凝縮する分子数が等しくなった状態のことです。
例えば、下図のように、液体の表面にある粒子が他の液体の粒子との分子間力を振り切って蒸発する分子数(蒸発する速さ)と、気体となっている粒子が液体粒子との分子間力に捕まって凝縮する分子数(凝縮する速さ)が等しくなった状態が、気液平衡という状態なのです。
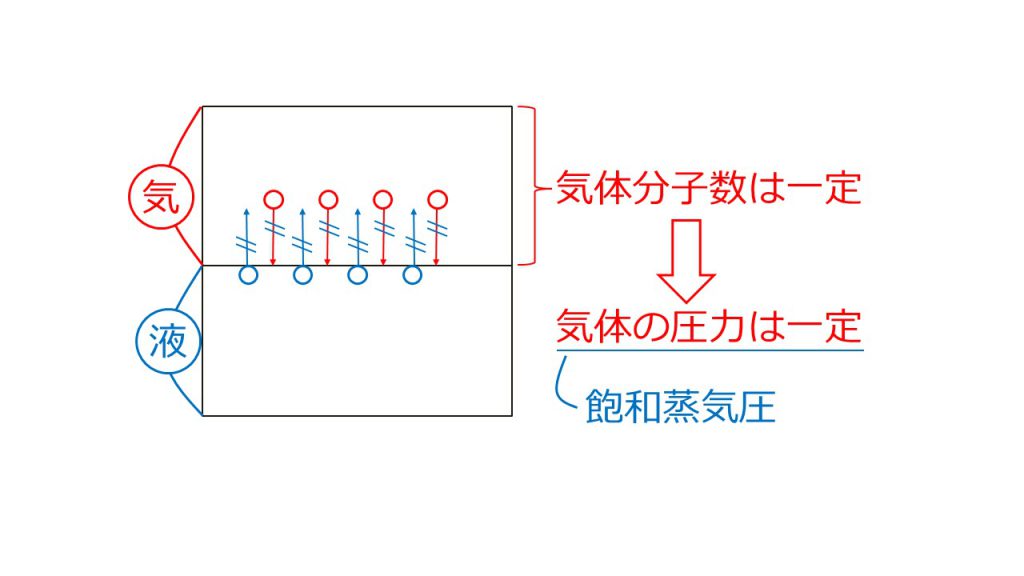
そのため蒸発していく粒子と同じ数だけ凝縮してくるので、見かけ上は蒸発が止まったような状態となります。ただし、蒸発が止まったように見えるのはあくまで見かけ上で、実際は絶えず蒸発と凝縮が繰り返されています。
そして、このような気液平衡の状態にあると、凝縮した分子の数だけ蒸発してくるので、気体分子の数は一定となります。
気体の圧力は気体分子の衝突によって考えることができるので、容積が変わらず温度が一定であれば、気体の圧力も一定となります。そして、この気液平衡の状態で一定となった圧力のことを飽和蒸気圧と呼んでいるのです。
これで飽和蒸気圧とは何かについて理解できたと思うので、閉鎖系の気体の燃焼の計算問題の解法の方針を確認します。
閉鎖系の気体の燃焼の計算問題の解法の方針
それでは、計算方針について確認していきます。
まず基本的な計算方針は、未反応のものがある反応なので、反応前・変化量・反応後の表を作ります。そして、理想気体の状態方程式で方程式を立てます。これが基本的な計算方針です。
ただ、閉鎖系の気体の燃焼は注意しないといけないことがあり、それは「気液平衡の状態にある気体の分圧は飽和蒸気圧になる」ということです。つまり気液平衡の状態にある気体は、それがどのような気体であれ、あるいは容器の体積や温度や他の気体の分圧がどのようになっていようとも、その気体の分圧は必ず飽和蒸気圧となります。この点を意識できるかどうかがポイントとなります。
では、その気体が気液平衡の状態にあるかどうかをどのように判断するのかというと、それは「液体が存在するかどうか」です。つまり、液体が存在していれば、その液体の量に関わらず、その気体は必ず気液平衡の状態となります。なぜなら液体の表面で蒸発と凝縮が絶えず繰り返されているからです」
液体が存在するかどうかの判断方法
では、液体が存在するかどうかはどのように判断すればよいのでしょうか。
その判断の方法は、まず液体が存在せず全て気体となっていると仮定します。そして、この仮定のもとでその気体の分圧を求めます。
全て気体となっている仮定のもとでの分圧が、その気体のその温度での蒸気圧よりも小さい場合は、この仮定は正しく、全て気体となっているので液体は存在しないと判断することができます。
これに対して、全て気体となっているという仮定のもとでその気体の分圧を求めてみたら、その気体の同じ温度での蒸気圧よりも大きくなっていた場合は、この仮定が誤りであるということになるので、全て気体ではなく、液体が存在するということになります。そして液体が存在するということは、気液平衡の状態にあると判断することができます。
これらのことから、飽和蒸気圧は気体になれる限界を示していると考えることもできます。つまり、気体圧力が飽和蒸気圧よりも小さい場合は、まだその気体を容器に入れる余地があるということになります。そして、気体の圧力が飽和蒸気圧を超えるということもあり得ないので、飽和蒸気圧を超えそうになった分だけ、気体の圧力を下げる、つまり気体の分子数を少なくしようとして、気体は凝縮していくのです。
以上が飽和蒸気圧の重要なポイントです。ちなみに、液体が存在するかどうかの判断の方法は、溶解度積を使って沈殿が生じるかどうかを判断する方法と似ています。そちらとも併せて復習すると、学びをより深めることができると思います。
問題演習①(飽和蒸気圧を考えない問題)
それでは以下の問題を解きます。
27℃でモル比1:1のO2CH2の混合気体を1.0Lの密閉容器に封入した。全圧は0.90×105Paだった。温度を327℃に保ちながらH2の量が半分になるまで反応したときの全圧を求めよ。ただしこの密閉容器の容積は反応の前後で一定であるとし、有効数字は2桁で答えます。
それでは早速答案を確認していきます。

まずは反応前のH2の物質量をn[mol]とします。すると、反応前のモル比は1:1なので、反応前のO2の物質量もn[mol]となります。
この反応前の水素と酸素の物質量は、この時点でもn=0.90×105/2×300Rと求めることができます。しかし、分数となってしまうので、この値を使って表を作ると表が見にくくなってしまいます。そこで、最初はnなどの文字で置いて、表と式を作ってからあとでnを代入する、といった方針で解くと計算しやすくなり、ミスも減らすことができます。もちろん、このn=0.90×105/2×300Rを使って、表や式を作っても見にくくはなりますが間違いではありません。
それでは今回は未反応のものがある反応なので、反応前・変化量・反応後の表を作ります。今回の反応は水素と酸素の反応なので、水素の燃焼反応だと考えて、化学反応式は
2H2+O2→2H2O
のようになります。
まずは反応前ですが、反応前のモル比は1:1なので、水素と酸素の物質量はともにnです。そしてH2Oは反応前なので0です。次に変化量ですが、今回は水素の量が半分になるまで反応をさせるので、水素の変化量が−1/2nとなります。そして化学反応式の係数の比が2:1:2なので、酸素の変化量は−1/4nとなり、水の変化量は+1/2nとなります。したがって反応後は、(反応前+変化量)なので、反応後の水素の物質量は1/2nで、反応後の酸素の物質量は3/4nとなります。そして反応後のH2Oの物質量は1/2nとなります。
これで反応前と反応後のそれぞれの物質量が分かったので、反応前の理想気体の状態方程式と反応後の理想気体の状態方程式を立てて、問題を解いていきます。
まずは、反応前の混合気体の理想気体の状態方程式を立てると、反応前の全圧は0.90×105Paで、容器の容積は1.0Lです。そして、物質量は混合気体の物質量なのでn+n=2n[mol]で、気体定数をRとして、温度はケルビンにするために反応前の27℃に273を足します。あとは、これを代入した式をnについて解くと、n=0.90×105/2×300Rのようになります。
ポイントは、ここでの計算はしないで取っておくということです。特に気体定数の計算は最後までとっておくようにしましょう。
そして次に、反応後の状態方程式を立てたいのですが、ここでこの反応後の水の状態を考えないといけません。基本的に気体の燃焼の問題では、H2Oが気液平衡の状態(液体の水を含む)か、あるいは全て気体(水蒸気)となっているかを判断しないといけません。ただ、今回は温度が327℃ととても高温で、しかも問題文に水の蒸気圧の情報を書いていないので、今回この反応後のH2Oの状態は、全て気体であると判断します。
そのため、反応後の混合気体とは1/2n[mol]の水素と3/4n[mol]の酸素と、1/2n[mol]の水蒸気の混合気体であるとして、式を立てます。それでは求める反応後の全圧をP全とし、反応後の混合気体の理想気体の状態方程式を立てます。

この方程式を整理し、nの値を代入すると、気体定数を含めて約分されていくので、式がP全=1.575×105と簡単になり、計算して、有効数字が2桁になるように四捨五入すると、答えは1.6×105Paとなります。
いかがでしょうか。まずは飽和蒸気圧を考えないで解く閉鎖系の気体の燃焼の問題の解法と流れを確認しました。次は、飽和蒸気圧を考えるタイプの問題を解きます。
演習問題②(飽和蒸気圧を考える問題)
それでは次は先ほどの問題の続きとして、この問題を解きます。
27℃でモル比1:1のO2CH2の混合気体を1.0Lの密閉容器に封入した。全圧は0.90×105Paだった。温度を上げて、H2を全て反応させた後、温度を27℃に戻した。このときの全圧を求めよ。容積は一定で、有効数字2桁で求めます。さらに27℃における水の飽和水蒸気圧は0.040×105Paとします。
反応前の状態は先ほどの問題と同じです。しかし今回は水素を全て反応させ、そしてさらに温度を27℃に戻します。特にこの温度を27℃に戻すということに注意しましょう。
それでは答案を確認していきます。

化学反応式は先ほどと同じで、反応前の水素と酸素の物質量も先ほどと同じになります。
そのため今回も反応前の水素と酸素の物質量をnとして、反応前・変化量・反応後の表を作ります。まず反応前ですが、反応前の水素と酸素の物質量はともにn[mol]で、反応前のH2Oの物質量は0となります。次に変化量ですが、今回は水素を全て反応させるので水素の変化量は−nとなります。そして化学反応式の係数の比は2:1:2なので、酸素の変化量は−1/2nとなり、H2Oの変化量は+nとなります。したがって、反応後のそれぞれの物質量は水素が0で、酸素が1/2nでH2Oがnとなります。
これで表ができたので、反応後の状態方程式を立てていきたいのですが、ここで注意しないといけないのは、反応後のH2Oの状態です。しかも今回は27℃にしているので、液体のH2Oが存在する可能性は十分にあります。
そこで、この反応後のH2Oに液体のH2Oが存在するかどうかを判断するために、H2Oが全て気体であると仮定し、その仮定のもとでのH2Oの分圧を求めてみます。
この仮定のもとでのH2Oの分圧をP仮として、状態方程式を立てます。あとは、この式を計算していきます。nは先ほどの問題で使ったnと同じなので、それを代入して約分をすると、H2Oが全て気体であると仮定したときのH2Oの分圧はP仮=0.45×105Paとなります。
そしてこれは、27℃におけるH2Oの飽和蒸気圧(0.040×105Pa)を上回っており、気体の分圧がその温度における飽和蒸気圧を超えることはありえないので、H2Oが全て気体であるという仮定は誤りであるということが分かります。したがって、H2Oは気液平衡の状態、つまり液体のH2Oが存在することになります。
よって、問1のように反応後の混合気体の物質量を1/2n+n[mol]とするこはできません。なぜなら、このn[mol]は水蒸気だけの物質量ではなく、水蒸気と液体のH2Oの物質量を合わせたものになるからです。
よって、問1のように反応後の混合気体の全圧を使って、状態方程式を立てることができないので、この問題は水蒸気となっているH2Oの分圧と酸素の分圧をそれぞれ求めて、求めた分圧を足すことで全圧とします。

まず、水蒸気となっているH2Oの分圧は飽和蒸気圧と等しくなるので、PH2O=0.040×105Paとなります。気液平衡の状態にある気体の分圧は、その気体の物質量や容器の体積に関わらず、必ず飽和蒸気圧となります。
次に酸素の分圧は、状態方程式を立てて求めます。nに最初に求めたものを代入すると、やはり約分ができ、計算すると、0.225×105Paとなります。
よって、求める全圧をP全とすると、P全=PH2O+PO2なので、P全=0.265×105となり、有効数字が2桁となるように四捨五入すると、答えは2.7×104Paとなります。
いかがだったでしょうか。そもそも液体の水が存在するかつまりH2Oが気液平衡の状態にあるかを確認して、その上で飽和蒸気圧を使って、全圧を求めるという解法の流れが理解できたでしょうか。
今回扱った問題は、問1が飽和蒸気圧を考えなくてよい閉鎖系の気体の燃焼の問題で、問2が飽和蒸気圧を考えないといけない閉鎖系の気体の燃焼の問題でした。この2問は対比させながら復習するようにすると理解がより深まると思います。
- 閉鎖系の気体の燃焼の計算の応用問題はこちら→気体の燃焼後に生じる水の質量を求める問題の解法
(3)解説授業の内容を復習しよう
(4)気体の燃焼の計算の解説
①気体の燃焼(開放系)の計算(化学反応式を使った計算の仕方、燃焼の化学反応式の作り方についても解説しています)
②気体の燃焼(開放系)の計算の応用問題(複雑に見える問題でも1つの方程式にすることができます)
③気体の燃焼(閉鎖系)の計算(気液平衡とは何か、飽和蒸気圧の使い方、液体が存在するかどうかの判断の方法についても解説しています)
(5)参考
☆化学の解説動画・授業動画一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識テスト一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学の解説・授業・知識・演習問題一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学の語呂合わせ(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
「化学計算の王道」シリーズは『思考訓練の場としての体系化学』(GHS予備校)を参考にしています。
GHS予備校についてはこちら→https://ghs-yobikou.co.jp/
思考訓練シリーズの購入はこちら→https://ghs-yobikou.shop/
