(1)解説授業動画
☆YouTubeチャンネルの登録をよろしくお願いします→大学受験の王道チャンネル
(2)解説授業の原稿
今回は開放系の気体の燃焼の計算の解説をします。
気体の燃焼の問題には2種類のパターンがある
気体を燃焼させる問題は、開放系と閉鎖系の2種類があります。
開放系とは、大気中で気体を燃焼させる問題のことです。そのため、開放系の問題は、空気が無限にあると仮定して考えます。
また、閉鎖系の問題は、容積の決まった容器の中で気体を燃焼させます。
この2つの問題の違いは、開放系では空気が無限にあると仮定しているので、基本的に反応が完全に進行し、過不足なく反応します。
それに対して閉鎖系は、密閉された容器の中で燃焼させるので、全ての気体が燃焼できず未反応のものが出てきます。また、容器の中に液体が発生したら、閉鎖系では蒸気圧を考える必要があります。
そのため、一般的には、開放系よりも閉鎖系の方が、問題がややこしくなりやすいです。
今回は開放系だけを解説します。閉鎖系の問題に関しては、別の動画で解説する予定ですので、そちらをご覧になってください。
気体の燃焼(開放系)の計算のポイント
それでは、開放系の気体の燃焼の計算のポイントについて確認します。
気体の燃焼の問題でとにかく重要なのが、「化学反応式の係数の比は物質量の比である」』という原則です。
この原則を使うことで方程式を立てられるようになり、問題を解くことができるようになります。
- 酸化還元反応の計算でもこの原則は使えます→酸化還元反応の計算(過マンガン酸イオンの色、滴定の終点についての解説もしています)
例題
それでは実際に問題を解いてみます。
メタンと一酸化炭素が、体積比で3:2の混合気体がある。この混合気体52gを酸素で完全燃焼させたとします。ただし、水素の原子量は1で、炭素の原子量は12で、酸素の原子量は16とします。
この問題設定に対して4つの小問を解きます。
ⅰ)この混合気体中の、メタンと一酸化炭素の質量を求めます。
ⅱ)メタンと一酸化炭素が燃焼するときの化学反応式を書きます。
ⅲ)混合気体が完全燃焼するのに必要な酸素の質量を求めます。
ⅳ)この燃焼によって発生する二酸化炭素の、標準状態での体積を求めます。
小問①:気体の体積比から質量を求める
それではまず1問目を解きます。
メタンと一酸化炭素の体積比が3:2であるということ、そしてこの混合気体の質量の合計が52gであるということ、この2つの条件を使ってそれぞれの質量を求めてみます。
方程式が2つ必要
まずは、それぞれの質量をwCH₄、wCOとおきます。すると合計が52gなので、wCH₄+wCO=52となります。
今回求める文字が2つあるので、方程式は2つ必要です。そのため体積比の条件を使って方程式を作らないといけません。
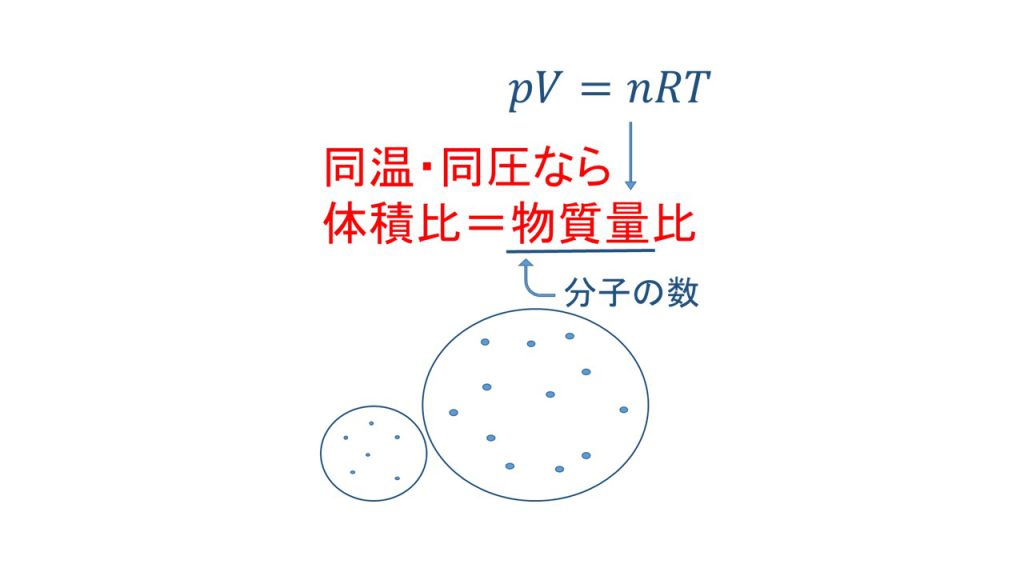
同温・同圧のとき、気体の体積比は物質量の比となる
ここでポイントとなるのは、「同温・同圧の条件なら、気体の体積比は物質量の比となる」ということです。
これは物質量というものが分子などの粒の数を表している、ということを知っていれば理解できると思います。他が全て同じ条件のとき、気体の体積が大きいということは、それだけ気体分子の数が多いということなので、気体の体積と物質量は比例するのです。
ちなみに理想気体の状態方程式を知っていれば、このことは式でも確認することができます。圧力と温度が一定であれば、気体定数も一定なのでVとnは比例します。
方程式を立てる
それでは、このことを使って方程式を作ります。

メタンの分子量が16で、一酸化炭素の分子量が28です。
メタンと一酸化炭素の体積比はメタンの物質量と一酸化炭素の物質量の比となるので、後はこの比例式を整理して、wCH₄+wCO=52と連立させればメタンの質量が24gで一酸化炭素の質量は28gとなります。
これでまず、それぞれの質量を求めることができました。
小問②:気体の燃焼の化学反応式を書く
それでは次に2問目の、メタンと一酸化炭素が燃焼するときの化学反応式を書きます。
よくある間違い
まず、よくある間違いを書きます。
2CH4 + 2CO + 5O2 → 4CO2 + 4H2O
このように書いてしまう人がいるのですが、これは間違いです。なぜなら、メタンと一酸化炭素は、この2つで反応することがないからです。
あくまでメタンと酸素が反応し、それとは別に一酸化炭素と酸素が反応しているのです。そのため、このように1つの化学反応式で書いてはいけません。
メタンの燃焼の化学反応式
まずは、メタンと酸素の燃焼の化学反応式を書き、その後、一酸化炭素と酸素の化学反応式を書きます。
それでは燃焼の化学反応式の書き方のポイントを解説しながら、メタンと酸素の化学反応式を作っていきます。
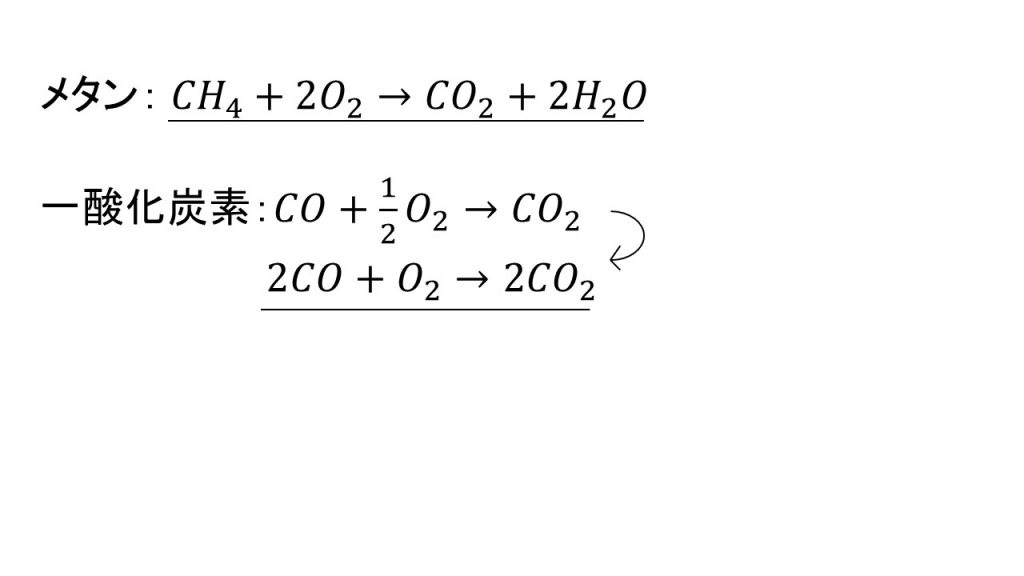
ⅰ)まずは左辺に反応物を書きます。このとき、係数の部分に数字を書くスペースを空けておきましょう。
ⅱ)そして、右辺の反応物ですが、炭素と水素と酸素からなる物質を完全燃焼させたときに発生する物質は、二酸化炭素と水なので、この2つを右辺に書きます。
ⅲ)そして、まず炭素の数をそろえます。今回は左辺と右辺の炭素の数が、ともに1個で揃っているので、係数を書く必要はありません。
ⅳ)次に、水素の数を確認します。今回、左辺の水素の数は4つで、右辺の水素の数は2つなので、右辺の水の係数を2とします。
ⅴ)そして最後に、酸素の数をそろえます。左辺の酸素の数が2個で、右辺は4個なので、左辺の酸素の係数を2とします。
これでメタンの燃焼の化学反応式の完成です。燃焼の化学反応式を作るときのポイントは、「酸素の係数を最後に調整する」ということです。これをすることで、簡単に化学反応式を作ることが出来ます。
一酸化炭素の燃焼の化学反応式
それでは同様のやり方で一酸化炭素の燃焼の化学反応式を作っていきます。
ⅰ)まずは左辺に反応物を書き、右辺に生成物を書きます。今回、一酸化炭素にはHが含まれていないので、水は発生しません。
ⅱ)そして次に、炭素の数を揃えます。今回は両辺ともに1つなので、係数を付ける必要がありません。
ⅲ)そして最後に、酸素の数をそろえます。左辺が3個で右辺が2個なので、酸素の係数を1/2として調整します。このように必要があれば分数を使って調整してください。
ⅳ)調整が終わったら、両辺を2倍して化学反応式の完成です。
これで2問目もできました。
小問③:燃焼に必要な酸素の質量
それでは3問目を解いていきます。3問目は、この混合気体の燃焼に必要な酸素の質量を求めます。ここからが気体の燃焼の計算の問題となります。
まずは、求める酸素の質量を文字でおき、wO₂とします。酸素のモル質量は、32g/molとなります。
方程式を立てて解く
それでは先ほど求めた、メタンの燃焼の化学反応式と、一酸化炭素の燃焼の化学反応式を使って方程式を作っていきます。
ここでポイントとなるのは、最初に確認した、「化学反応式の係数の比は、物質量の比である」という原則です。この原則を使って方程式を作ります。

まず左辺は、酸素の質量を酸素のモル質量で割ることで、酸素の物質量とします。
そして、方程式なので、右辺も酸素の物質量とします。
まずは、メタンの燃焼に必要な酸素の物質量を求めていきます。メタンの質量をメタンのモル質量で割ることで、まずメタンのモルとなります。そして化学反応式を見ると、メタンと酸素の係数の比が1:2となっているの、でメタンのモルに2倍することで、メタンの燃焼に必要な酸素のモルとなります。
同様にして、一酸化炭素の燃焼に必要な酸素の物質量を求めていきます。
まずは一酸化炭素の質量を一酸化炭素のモル質量で割ることで、一酸化炭素のモルとなり、化学反応式を見ると、一酸化炭素と酸素の係数の比が2:1なので、一酸化炭素と酸素の物質量の比も2:1ということであり、一酸化炭素の物質量に1/2倍することで、その物質量となります。
これで方程式ができたので、あとはこの方程式を解けば、答えを求めることができます。
まずは、この方程式の右辺が簡単に約分できるので、約分できるだけ約分をしておきます。そして右辺を整理して、両辺を32倍して計算すると、答えは112gとなります。
このように気体の燃焼の計算は、化学反応式の係数の比を使って方程式を立てるようにすると解けるようになります。
小問④:燃焼によって発生する二酸化炭素の体積
それでは最後に4問目を解きます。燃焼によって発生する二酸化炭素の、標準状態での体積を求めてみます。
方程式を立てて解く
この問題も先ほどと同様に、「化学反応式の係数の比が、物質量の比である」ということを使って方程式を立てて解きます。

まずは求める体積をVとおきます。ちなみにメタンのモル質量は16g/molで一酸化炭素のモル質量は28g/molです。
やはり、この2つの化学反応式の係数を使っていきます。
まず左辺は、求める二酸化炭素の体積を標準状態なので22.4L/molで割り、二酸化炭素の物質量とします。
そして方程式なので、右辺も二酸化炭素の物質量とします。まずはメタンの反応がすることによって発生する二酸化炭素の物質量を求めます。メタルの質量をメタンのモル質量で割り、メタルのモルとし、メタンの燃焼の化学反応式において、メタンと二酸化炭素の係数の比は1:1なので、×1をすることで二酸化炭素の物質量とします。
同様に一酸化炭素の質量を一酸化炭素のモル質量で割り、一酸化炭素のモルとした後、一酸化炭素の燃焼の化学反応式において、一酸化炭素と二酸化炭素の係数の比が2:2、つまり1:1なので、×1をすることで、二酸化炭素の物質量となります。
これで方程式ができたので、あとはこの方程式を解いて答えを出します。
まずは右辺が簡単に約分できるので約分をして、右辺を整理して、両辺を22.4倍して分母をはらい、掛け算をして、答えは56Lとなります。
このように、この問題も化学反応式の係数の比を使って、物質量を出し、方程式を作って解くことができました。
いかがだったでしょうか。このように化学反応式の係数の比を使って、求めたい物質の物質量を出す、ということは気体の燃焼以外でも使う計算方法です。ぜひ使いこなせるようになっておきましょう。
- 酸化還元反応の計算でもこの原則は使えます→酸化還元反応の計算(過マンガン酸イオンの色、滴定の終点についての解説もしています)
(3)解説授業の内容を復習しよう
(4)気体の燃焼の解説一覧
①気体の燃焼(開放系)の計算(化学反応式を使った計算の仕方、燃焼の化学反応式の作り方についても解説しています)
②気体の燃焼(開放系)の計算の応用問題(複雑に見える問題でも1つの方程式にすることができます)
③気体の燃焼(閉鎖系)の計算(気液平衡とは何か、飽和蒸気圧の使い方、液体が存在するかどうかの判断の方法についても解説しています)
(5)参考
☆化学変化と化学反応式(化学基礎)の解説・授業・知識・演習問題一覧
☆化学の解説動画・授業動画一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識テスト一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学の解説・授業・知識・演習問題一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学の語呂合わせ(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
「化学計算の王道」シリーズは『思考訓練の場としての体系化学』(GHS予備校)を参考にしています。
GHS予備校についてはこちら→https://ghs-yobikou.co.jp/
思考訓練シリーズの購入はこちら→https://ghs-yobikou.shop/
