☆問題のみはこちら→酸化還元反応の計算(基本)(問題)
☆解説授業①:酸化還元反応の計算(過マンガン酸イオンの色、滴定の終点についての解説もしています)
☆解説授業②:酸化還元反応の化学反応式の作り方(硫酸酸性の過マンガン酸カリウムと硫酸鉄(Ⅱ)の反応)
※原子量:H=1, C=12, O=16
※③-2以外は有効数字2桁で答えよ。
①硫酸鉄(Ⅱ)水溶液25mLを硫酸で酸性にした後、0.020mol/Lの過マンガン酸カリウム水溶液を滴下したところ、20mL加えたとき溶液の色が変わり、終点に達したことがわかった。
1)この酸化還元反応の化学反応式をつくれ。

2)滴定の終点は溶液の色がどのように変化するときか。
答え:無色から赤紫色になり、かき混ぜても色が消えなくなったとき。
3)硫酸鉄(Ⅱ)水溶液のモル濃度を求めよ。

②硫酸酸性の過マンガン酸カリウムと過酸化水素を反応させる。
1)過マンガン酸イオンと過酸化水素それぞれの半反応式を示せ。
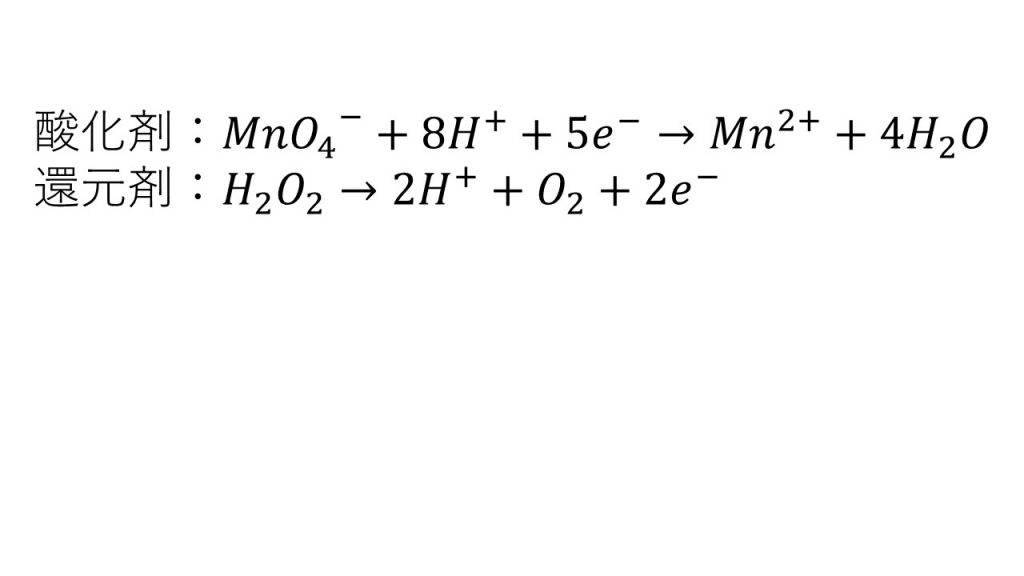
2)過酸化水素中のO、過マンガン酸イオン中のMnの酸化数の変化を述べよ。
O:ー1→0、Mn:+7→+2
3)0.10mol/Lの過マンガン酸カリウム溶液30mLに、溶液が無色になるまで3.0%の過酸化水素水(密度1.0g/mL)を加えると、最低何mL必要か。
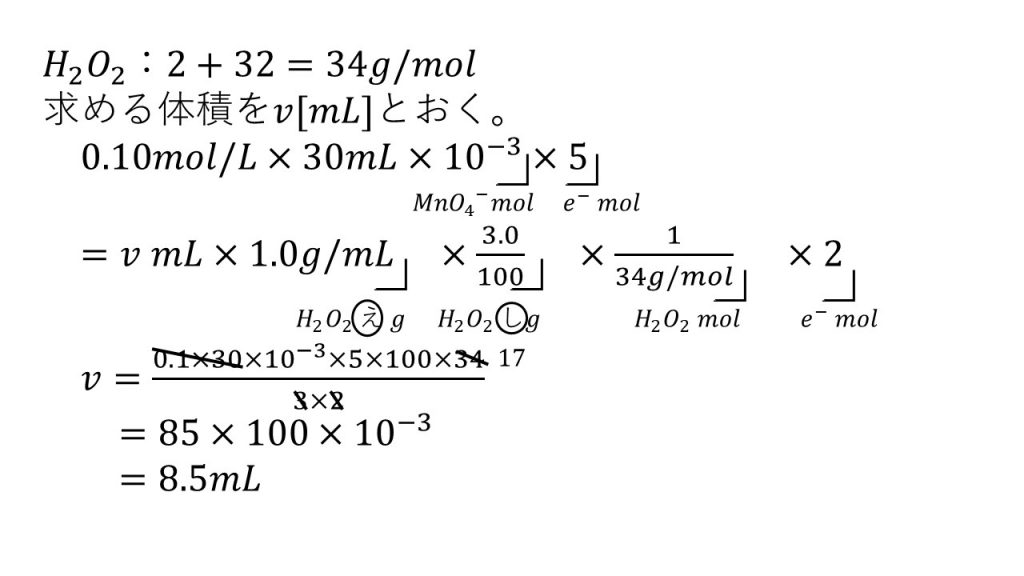
③シュウ酸二水和物を0.189gとり、50mLの蒸留水に溶解し、9mol/Lの硫酸10mLを加えた。これを約70℃に加熱しながら濃度未知の過マンガン酸カリウム溶液をビュレットで加えていったところ、ちょうど16.0mLで過マンガン酸イオンの色が消えずに残った。
1)この反応の化学反応式を示せ。

2)この過マンガン酸カリウム溶液のモル濃度を求めよ。有効数字は3桁とする。
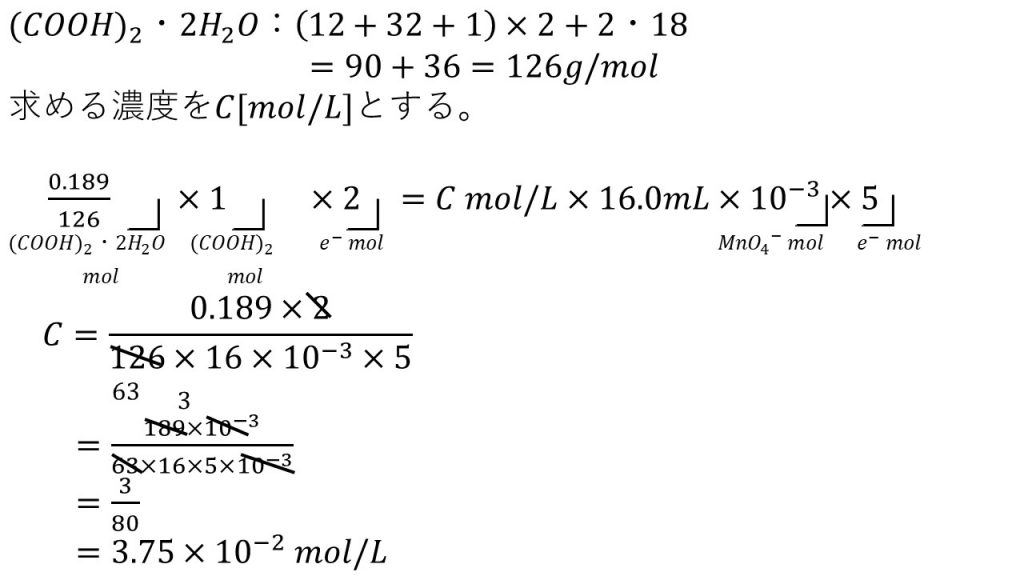
☆問題のみはこちら→酸化還元反応の計算(基本)(問題)
【解説授業】
①酸化還元反応の計算(過マンガン酸イオンの色、滴定の終点についての解説もしています)
②酸化還元反応の化学反応式の作り方(硫酸酸性の過マンガン酸カリウムと硫酸鉄(Ⅱ)の反応)
【その他参考になる解説】
①ヨウ素滴定の解説(チオ硫酸イオンとは何か、ヨウ素デンプン反応についても解説しています)
「化学計算の王道」シリーズは『思考訓練の場としての体系化学』(GHS予備校)を参考にしています。
GHS予備校についてはこちら→https://ghs-yobikou.co.jp/
思考訓練シリーズの購入はこちら→https://ghs-yobikou.shop/
~参考~
☆化学計算の王道(化学基礎)←その他の化学基礎の単元の計算問題と解説
☆化学計算の王道(化学基礎・理論化学) ←理論化学の計算問題と解説はこちら
☆酸化還元反応と金属のイオン化傾向(化学基礎)の解説・授業・知識・演習問題一覧
☆化学の解説動画・授業動画一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識テスト一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学の解説・授業・知識・演習問題一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
