(1)解説授業動画
☆YouTubeチャンネルの登録をよろしくお願いします→大学受験の王道チャンネル
(2)解説授業の原稿
電気分解の反応の順番を確認します。電気分解において陰極と陽極で起きる反応には、反応の起きやすさの順番にルールがあります。このルールは必ず頭に入れましょう。これを知らないと電気分解の問題はまったく解けません。
電気分解における陰極の反応のルール
それでは陰極の反応から確認していきます。

陰極では還元反応が起きているので還元されやすい順に反応が起きます。
①まずは水溶液中に銀イオンや銅イオンがある場合は、それらが還元されて銀や銅が析出します。もう少し正確にいうと、水素よりもイオン化傾向が小さい金属のイオンが水溶液中にある場合は、それが還元されます。なぜならイオン化傾向が小さいということは還元されやすいということなので、水素の発生よりも優先して還元反応が起きるからです。
②次に水溶液中に銀イオンや銅イオンがなく、水溶液が酸性の場合、水素イオンが還元されて水素が発生します。水溶液が酸性であれば、水素イオンはたくさんあるので、この反応が起きます。
③そして最後に水溶液中に銀イオンや銅イオンがなく、さらに水溶液が酸性でもないときは水が還元されて水素と水酸化物イオンが生成します。水の反応は最後に起きるということは覚えておきましょう。そもそも水は酸化還元反応がしやすい物質ではないので、その他の条件が満たされていないときに、やっと反応するのです。
また水素よりもイオン化傾向が大きい金属は析出することが基本的にありません。なぜならイオン化傾向が大きいということは還元されにくいということなので、水素が発生する状況であれば、水素よりもイオン化傾向の大きい金属は還元されず、水素の発生が優先されるからです。
さらに、③の反応(水の還元反応)が起きたときは水酸化物イオンが出るということにも注意しましょう。つまり、この反応が起きた後は水溶液は塩基性になります。
電気分解における陽極の反応のルール
続いて陽極の反応を確認します。

陽極では酸化反応が起きます。そのため酸化されやすい順で反応が起きます。
①陽極の場合はまず電極を確認しましょう。電極が金属の場合は、その金属電極が溶解します。例えば陽極の電極が銅の場合は、銅は酸化されて銅イオンとなり、水溶液に溶け出します。この金属というのをもう少し正確にいうと、プラチナPtや金Auよりもイオン化傾向が大きい金属のことです。プラチナPtや金Auは電気分解でも酸化させることができないので、これらを電極に使っても溶解することはありません。
②続いて電極がプラチナPtや炭素C、つまり電気分解によって溶解しない電極を使った場合は、水溶液に着目します。まず水溶液中にハロゲンのイオンがある場合は、それらが酸化されてハロゲンが発生します。例えば塩化物イオンがある場合は、塩化物イオンが酸化されて塩素が発生し、臭化物イオンがある場合はそれが酸化されて臭素が発生します。
③さらに電極がプラチナPtや炭素Cで、水溶液が塩基性の場合は水酸化物イオンが酸化されて酸素が発生します。
④そして、陽極もこれらの条件をすべて満たさなかった場合は水が反応します。水が酸化されて酸素と水素イオンが発生します。陰極も陽極も水が反応するのは最後であるということは覚えておきましょう。
また陰極で水が反応した場合は、水酸化物イオンが発生して、塩基性になるのに対して、陽極で水が反応した場合は、水素イオンが発生して、酸性になります。
これが電気分解の反応の順番です。必ず自分でできるようになるまで復習するようにしてください。
陰極と陽極の反応の例①:硫酸銅の電気分解
それではまず陰極と陽極でどのような反応が起きているのかを考えていきます。そのためにも簡単に図をかいて、電子の流れを確認しましょう。
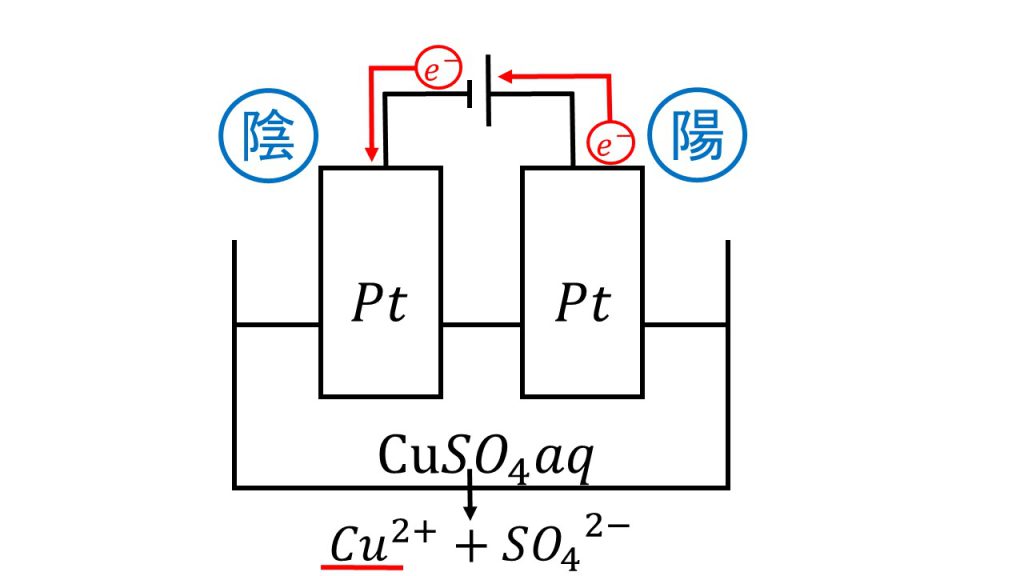
電子は負極から出て陰極に入り、陽極から出て正極に戻ります。このように電池や電気分解の問題を考えるときは、電子の流れる向きを確認するようにしましょう。これで陰極では還元反応が起き、陽極では酸化反応が起きているということが確認できたので、先ほど解説した酸化還元反応の反応の順番で陰極と陽極の反応を考えていきます。
陰極ですが、陰極はまず水溶液を見て銀イオンか銅イオンがないか確認します。今回は水溶液が硫酸銅水溶液なので、水溶液中には銅イオンが存在します。そのため陰極では銅イオンが還元されて、銅が析出しています。
陰極:Cu2+ + 2e– → Cu
次に陽極ですが、陽極はまず電極を見ます。今回電極は白金なので電極が酸化されることはありません。電極が白金のときは水溶液を見ます。水溶液にハロゲン化物イオンがあるかどうかを確認してみると、今回はありません。次に水溶液が塩基性かどうかを確認します。今回は硫酸銅水溶液なので塩基性ではありません。したがって今回反応しているのは、順番では一番最後の水となり、陽極では以下の反応が起きています。
陽極:2H2O → O2 + 4H+ + 4e–
陰極と陽極の反応の例②:塩化銅の電気分解
先ほどと同様に簡単に図をかき、電子の流れを確認した上で、陰極と陽極の反応を考えていきます。
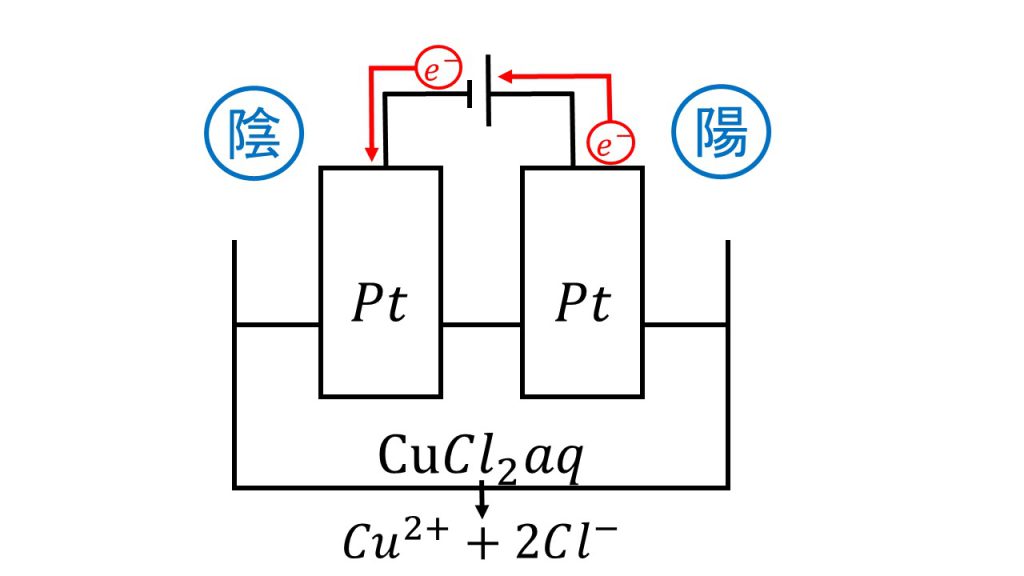
まず陰極ですが、水溶液を見て銀イオンか銅イオンがないか確認します。今回は塩化銅が電離して銅イオンがあるので、銅イオンが還元されて銅となります。
陰極:Cu2+ + 2e– → Cu
次に陽極ですが、まずは電極を見ます。電極は白金なので、次に水溶液を見ます。水溶液にハロゲン化物イオンがあるかどうかを確認してみると、今回は塩化銅が電離して塩化物イオンがあるので、陽極では塩化物イオンが酸化されて塩素となります。
陽極:2Cl– → Cl2 + 2e–
よって今回発生した気体というのが塩素のことです。
(3)解説授業の内容を復習しよう
(4)化学反応式の王道(電池と電気分解)の解説一覧
①電池の負極と正極の反応式(ボルタ電池、ダニエル電池、鉛蓄電池)
(5)参考
☆電池と電気分解(理論化学)の解説・授業・知識・演習問題一覧
☆化学の解説動画・授業動画一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識テスト一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学の解説・授業・知識・演習問題一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学の典型パターン一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
