☆問題のみはこちら→熱化学方程式の計算(問題)
☆解説授業①:熱化学方程式の解法①(エネルギー図を使った解法の解説、生成熱を扱った問題の解法)
☆解説授業②:熱化学方程式の解法②(蒸発熱の扱い方、結合エネルギーを扱った問題の解法)
☆解説授業③:熱化学方程式の解法③(黒鉛の昇華熱の考え方、熱化学方程式の応用問題)
※以下の問題は全て整数で答えよ。
※(固)(液)(気)はそれぞれ(s)(ℓ)(g)と表記する。
①黒鉛および水素の燃焼熱は、394kJ/mol, 286kJ/molである。またメタノールおよびエタノールの燃焼熱は726kJ/mol, 1370kJ/molである。メタノールおよびエタノールの生成熱を求めよ。



②加熱したコークスに水蒸気を通じると、
C(s) + H2O(g) = CO(g) + H2(g) -119kJ
また、生成した一酸化炭素は水蒸気と反応し、水素を生じる。
CO(g) + H2O(g) = CO2(g) + H2(g) + QkJ
1)水蒸気の生成熱を242kJ/molとして、CO(g)の生成熱を求めよ。
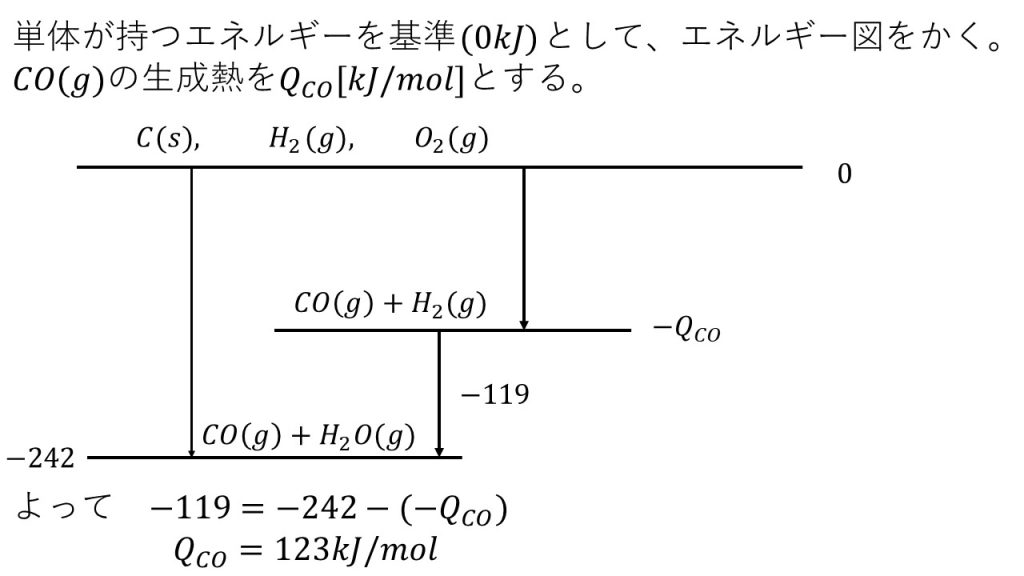
2)CO(g)の生成熱を394kJ/molとして、Qを求めよ。
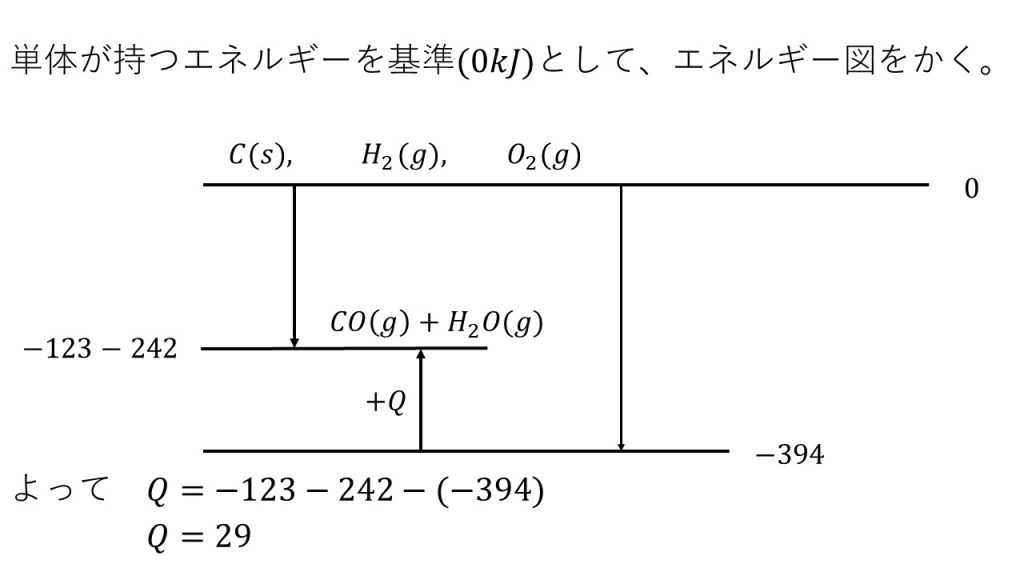
③二酸化炭素、水(液体)およびエタノールの生成熱は、それぞれ394kJ/mol、286kJ/mol、および277kJ/molであり、また、水の蒸発熱は44kJ/molである。次の熱化学方程式の反応熱Qを求めよ。
C2H5OH(ℓ) + 3O2(g) = 2CO2(g) + 3H2O(g) + QkJ

④白金を触媒にして、高温でアンモニアを酸素と反応させると、次式のように一酸化窒素と水(気体)が生じる。
4NH3 + 5O2 → 4NO + 6H2O
この反応によって一酸化窒素 1molが生成する時の反応熱を、次にあげる反応式を用いて計算せよ。
N2(g) + 3H2(g) = 2NH3(g) + 92kJ・・・(ア)
N2(g) + O2(g) = 2NO(g) -180kJ・・・(イ)
2H2(g) + O2(g) = 2H2O(g) + 484kJ・・・(ウ)

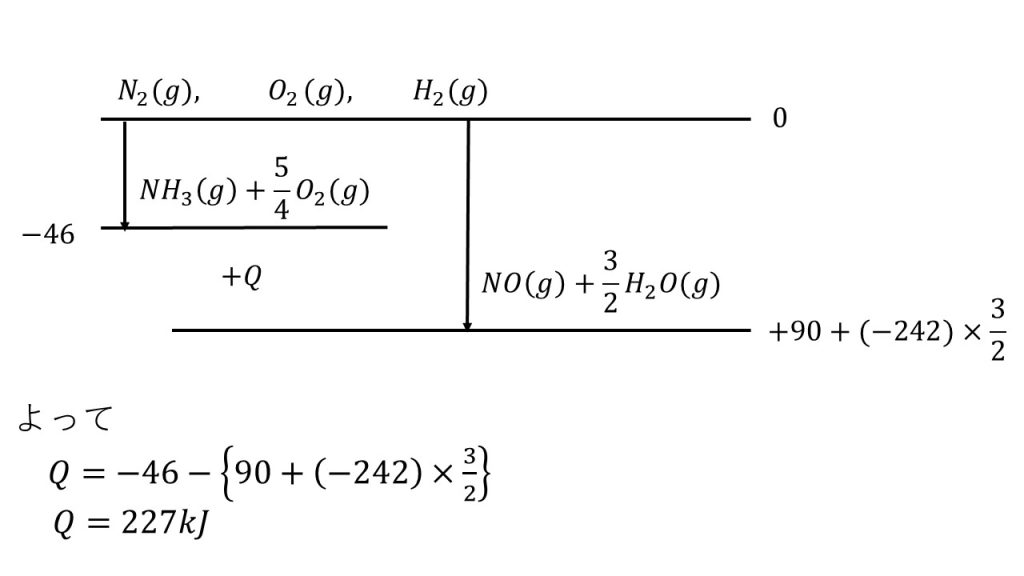
⑤結合エネルギーはH-Hが432kJ/mol、O=Oが494kJ/mol、O-Hが459kJ/molである。水蒸気の生成熱を求めよ。


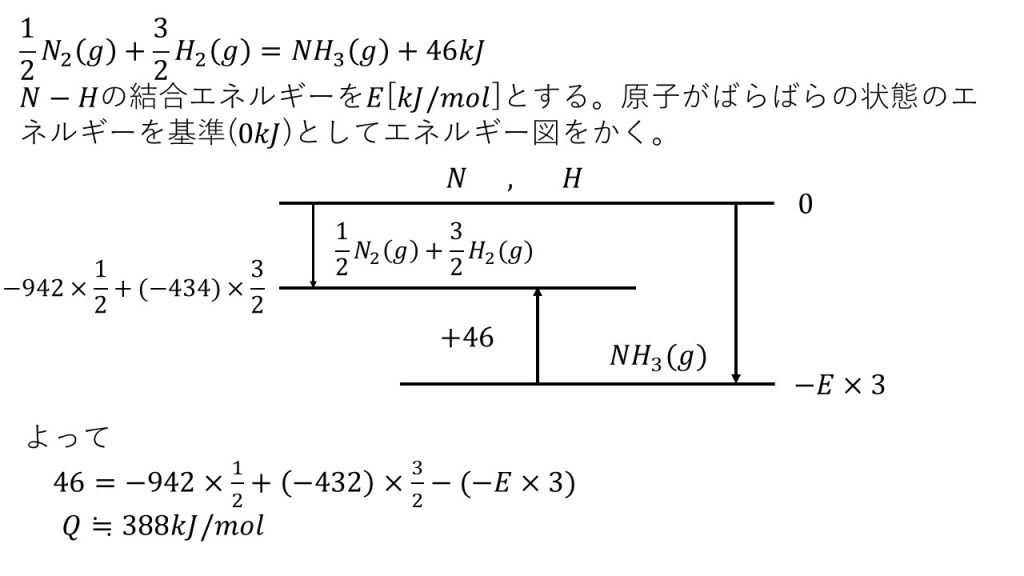
⑥アンモニアの生成熱は46kJ/molである。結合エネルギーはH-Hが432kJ/molであり、N≡Nが942kJ/molである。N-H結合の結合エネルギーを求めよ。
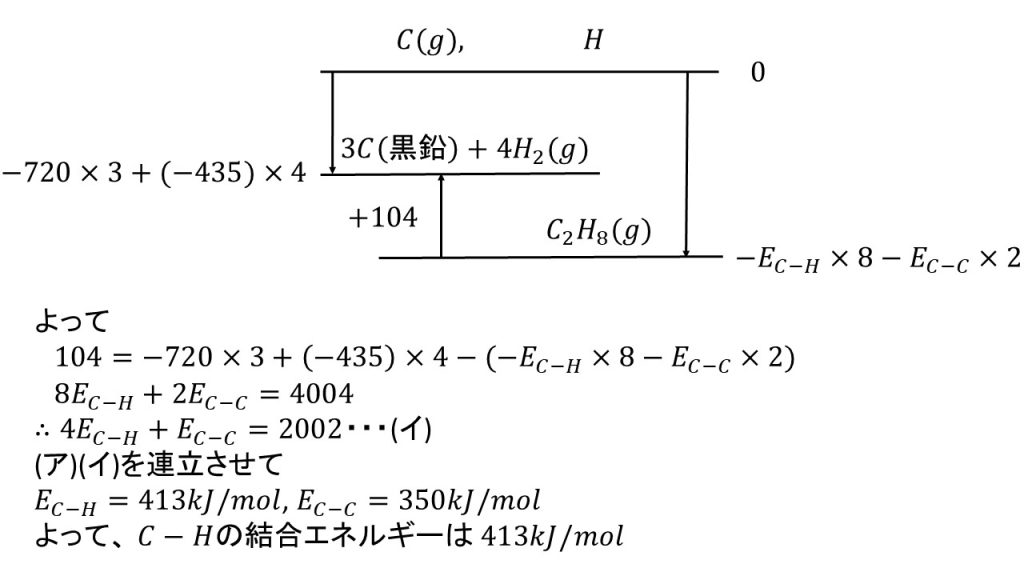
⑦エタンの生成熱は84kJ/molである。結合エネルギーはそれぞれH-Hが432kJ/mol、C-Cが368kJ/molである。また、黒鉛の昇華熱が715kJ/molとするとき、エタンのC-H結合の結合エネルギーを求めよ。

⑧次の熱化学方程式を用い、次の問いに答えなさい。
2H2(g) + O2(g) = 2H2O(g) + 484kJ・・・(ア)
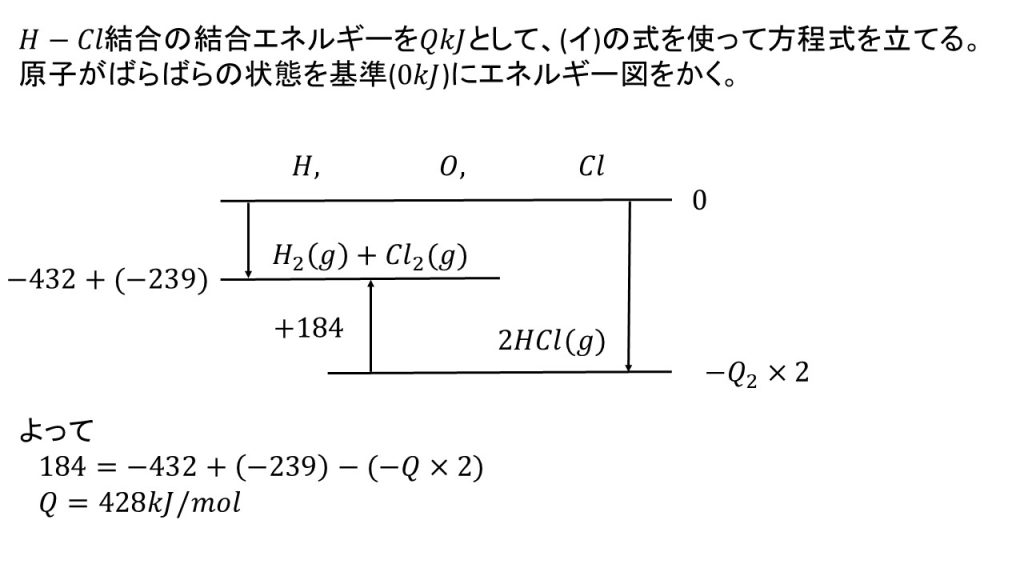
H2(g) + Cl2(g) = 2HCl(g) + 184kJ・・・(イ)
H2O(ℓ) = H2O(g) -44kJ・・・(ウ)
1)H2O(ℓ)の生成熱を求めよ。

2)H-H結合とCl-Cl結合の結合エネルギーは、それぞれ432kJ/mol、239kJ/molである。H-Clの結合エネルギーを求めよ。
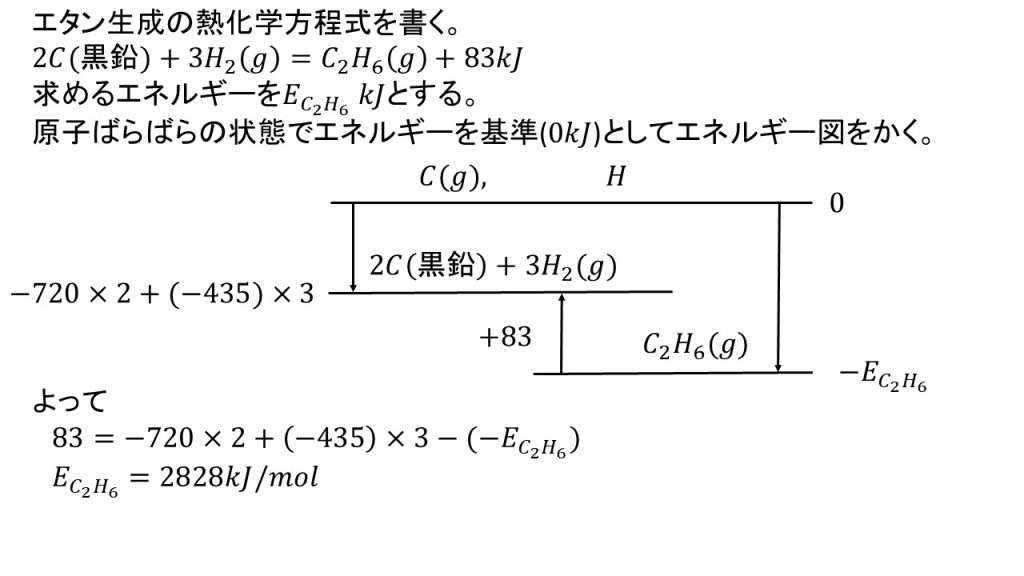
⑨H-H結合の結合エネルギーを435kJ/mol、黒鉛の昇華熱を720kJ/molとする。また、エタンおよびプロパンの生成熱はそれぞれ83kJ/molおよび104kJ/molである。
1)エタン 1mol中の結合をすべて切り水素原子および炭素原子に解離するのに要するエネルギーを求めよ。
2)C-H結合およびC-C結合の結合エネルギーは、化合物によらず一定であるとして、C-H結合の結合エネルギーを求めよ。

☆問題のみはこちら→熱化学方程式の計算(問題)
【解説授業】
①熱化学方程式の解法①(エネルギー図を使った解法の解説、生成熱を扱った問題の解法)
②熱化学方程式の解法②(蒸発熱の扱い方、結合エネルギーを扱った問題の解法)
③熱化学方程式の解法③(黒鉛の昇華熱の考え方、熱化学方程式の応用問題)
「化学計算の王道」シリーズは『思考訓練の場としての体系化学』(GHS予備校)を参考にしています。
GHS予備校についてはこちら→https://ghs-yobikou.co.jp/
思考訓練シリーズの購入はこちら→https://ghs-yobikou.shop/
~参考~
☆化学計算の王道(化学基礎・理論化学) ←その他の単元の計算問題と解説はこちら
☆化学の解説動画・授業動画一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識テスト一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学の解説・授業・知識・演習問題一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
