(1)解説授業動画
☆YouTubeチャンネルの登録をよろしくお願いします→大学受験の王道チャンネル
(2)解説授業の原稿
今回は、鉛蓄電池の計算の考え方について解説します。
鉛蓄電池とは何か?
まずは、そもそも鉛蓄電池とは何かについて確認します。
鉛蓄電池とは、下図のように負極に鉛、正極に酸化鉛を使い、電解液を希硫酸とした電池のことです。
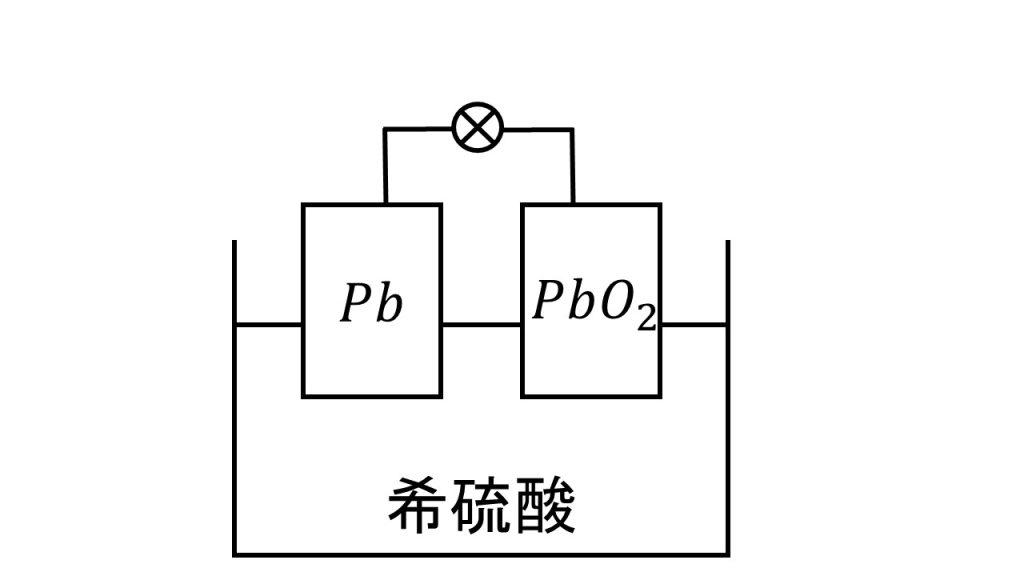
この鉛蓄電池において重要なポイントは、鉛蓄電池は二次電池であるということです。
二次電池とは充電出来る電池のことで、理論上鉛蓄電池は何回でも繰り返し放電と充電をすることができます。そのため、鉛蓄電池は現在でも車のバッテリーとして使われています。
鉛蓄電池の負極と正極の反応
では、なぜ鉛蓄電池は充電できるのでしょうか。その秘密は、負極と正極の反応にあります。そこで負極と正極の反応を確認しています。
鉛畜電池の負極と正極の反応は、反応物と生成物だけ覚えておけば、残りの部分は酸化還元反応の半反応式の作り方で作ることができます。
実際にやってみましょう。
負極における反応物は鉛で、生成物は硫酸鉛です。まずは、両辺のSの数を揃えるために左辺に硫酸イオンを追加します。次に鉛の酸化数の変化を確認すると0から+2に増加しており、これは電子を2つ放出したという意味なので、右辺に電子を2つ加えます。これで両辺の原子の数も電価の数も揃ったので負極の反応式が完成しました。
負極:Pb + SO42- → PbSO4 + 2e–
続いて正極です。まずは、両辺のSの数を揃えるために、左辺に硫酸イオンを加えます。そして次に、鉛の酸化数の変化を確認すると+4から+2に減少しており、これは電子を2つ受け取ったということなので、左辺に電子を2つ加えます。そして次に、両辺の電価の合計を確認してみると、左辺は-2と-2で合計-4であり、右辺は0なので、電価を両辺でつり合わせるために左辺に水素イオンを4つ加えます。そして最後に両辺のHとOの数をそろえるために、右辺にH2Oを2つ加えて正極の反応式が完成しました。
正極:PbO2 + SO42- +4H+ + 2e– →PbSO4 + 2H2O
なぜ鉛蓄電池は二次電池なのか?
理由①:硫酸鉛が水に難溶であるから(極板に付着するから)
この鉛畜電池の負極と正極の反応において注意しないといけないことが1つあります。
それは、右辺の硫酸鉛を鉛イオンPb2+と硫酸イオンSO42-の形で書いてはいけないということです。なぜこのように書けないのかというと、硫酸鉛は水に溶けない塩なので、水溶液中でこのように電離していることはないからです。
そのため放電を続けていれば、下図のように硫酸鉛は負極と正極の両方の電極に付着していきます。

そして、このことがまさに鉛蓄電池が二次電池である理由になります。
充電をさせるためには、
負極:PbSO4 + 2e– → Pb + SO42-
正極:PbSO4 + 2H2O → PbO2 + SO42- +4H+ + 2e–
このように放電とは逆向きの反応を起こさないといけません。そのため放電のときとは、逆向きに電子が流れるように電池に接続するのですが、このとき重要になるのが負極が硫酸鉛で覆われているということです。
つまり、つないだ電池の負極から放出された電子を受け取るのが硫酸鉛となるので、この逆向きの反応が起きるのです。
もし硫酸鉛が付着していなかったら電子は水素イオンが受け取ってしまいます。そうなると水素が発生(2H+ + 2e– → H2)してしまい、この逆反応が起きなくなり、充電することはできなくなります。
しかし硫酸鉛は、水に溶けず電極に付着しているので、水溶液の水素イオンよりも先に硫酸鉛が電子を受け取ることができ、この逆反応を起こすことができるのです。
理由②:気体が発生しないから
また鉛蓄電池が二次電池として使える理由がもう1つあります。
それは、負極と正極の反応で気体が発生しないということです。もし水素などの気体が発生してしまうと、電池の外に反応に必要なものが逃げていってしまい、逆反応を起こすことができなくなってしまいます。
しかし鉛蓄電池は、放電しても電極に付着する硫酸鉛と水しか発生しないので、希硫酸の濃度は小さくなりますが、電池の外に逃げていくものが何もないので逆反応を起こすことができ、理論上は何回でも繰り返し放電と充電をすることができます。
充電するときのつなぎ方
さらに2点ほど補足しておきます。
充電するときに電極を電池につなぐのですが、そのときのつなぐ向きは鉛側に負極、酸化鉛の方に正極をつなぎます。つまり負極どうしでつなぎ、正極どうしでつなぐと充電することができます。

もし向きがわからなくなったら、このように電子の流れる向きを確認して考えるようにしてください。
硫酸鉛の色は白色
また硫酸鉛の色は白色であるということは知っておきましょう。
ここまでが鉛蓄電池の基本的な知識となります。全て重要なことなので必ず頭に入れておきましょう。
鉛蓄電池の計算の考え方
それでは、鉛蓄電池の計算の考え方を解説します。
ポイントは、消費と生成と増減を区別するということです。
鉛蓄電池の計算が他の電池の計算に比べてややこしくなるのは、計算しなければいけないものが消費・生成と増減の2つの方向性があり、それがややこしくなるからです。そのためどちらを今計算しているのかをしっかりと区別して、意識しながら計算しないといけません。
鉛蓄電池全体の反応式
まずは、先ほどの負極と正極の反応を1つにまとめた式を確認します。「2PbSO4」と書かずに、あえて「PbSO4 + PbSO4」と分けて書きました。

また電池や電気分解の式をまとめて書くときは、このように電子の数を矢印の上にでも書くようにしましょう。
つまりこの反応では、電子が2mol放電したとき、負極では1mol の鉛が1molの硫酸鉛となり、正極では1molの酸化鉛が1mol の硫酸鉛となり、電解液では2molの硫酸が2molの水となります。
負極・正極・電解液での消費・生成
このことをふまえて、負極・正極・電解液のそれぞれで消費・生成あるいは、増減する質量を確認していきます。なお原子量はそれぞれ、H=1, O=16, S=3, Pb=207になります。
まずは、消費・生成を考えてみます。
電子が2mol流れたとしたら負極では、鉛が207g 消費され硫酸鉛が303g生成されます。この「207」という数字は、鉛のモル質量から来ています。また「303」という数字は、硫酸鉛のモル質量から来ています。
つまり負極では電子を2mol放電するときは、鉛という物質は1molなくなって、代わりに硫酸鉛という物質が1mol生成されるということになります。これが消費と生成の意味です。
続いて正極では、酸化鉛が239g 消費されて、硫酸鉛が303g生成されます。こちらも負極のときと同様に、電子を2mol放電するときは、酸化鉛という物質は1mol分なくなり、硫酸鉛という物質が1mol生成されます。
そして電解液においては、電子が2mol流れたときは、溶質の硫酸が98×2g消費され、溶媒にある水が18×2g生成されます。
×2に注意してください。なぜ×2かというと、化学反応式において硫酸と水の係数が2になっているからです。
つまり電解液では溶質の硫酸がなくなり、代わりに溶媒の水が生成されるので、放電をしていれば電解液の濃度が減少するということが分かります。
負極・正極・電解液での質量の増減
次は増減を確認していきましょう。
電子が2mol流れたとしたら、負極が96g増加し、正極は64g増加し、電解液は80×2g減少します。つまり増減を考えているときは、電極自体あるいは、電解液全体を考えているということになります。
この96gはどこから来たかというと、負極で生成する硫酸鉛の質量から負極で消費される鉛の質量を引いたものとなります。化学式で見るとSO4分増加するので、その原子量の合計分だけ増加したと考えることもできます。
同様に正極の64gは、正極で生成した硫酸鉛の303gから正極で消費した酸化鉛の239gを引いたものとなります。これは、化学式で見るとSO2分増加しているので、この原子量の合計の分だけ増加したと考えることもできます。
さらに電解液は、消費される硫酸の質量から生成する水の質量を引いた分だけ減少することになります。化学式で見るとSO3が2つ分減少したとも考えることができます。
このように鉛蓄電池の計算を考えるときは、まずは消費・生成と増減のどちらを計算しないといけないかを考え、次に電子が2mol流れたときの質量の関係から式を立てていくという流れになります。
例題①:負極での消費
それでは、鉛蓄電池の計算問題を解いていきます。なお、電池の計算の基本は理解できているものとして話を進めていきます。もし理解が不十分な場合は、そちらの解説もご覧になってください。
それでは問題を確認していきます。
鉛蓄電池から10Aの電流を1時間取り出したとき、何gの鉛が消費されるか求めてみましょう。ただし有効数字は3桁とします。
今回は、「問題文に鉛が消費」と書いてあるので電極の増減を考えるのではなく、負極においてどれだけ鉛が消費されたか、つまりどれだけの鉛が反応で使われたかを考えていきます。
消費や生成を考える場合は、通常の電池の計算と同じ流れで解きます。
図をかき、電子の流れを確認して、負極と正極の反応式を書く
そのため電池の計算の基本に則って、まずは簡単に図をかき、電子の流れを確認します。
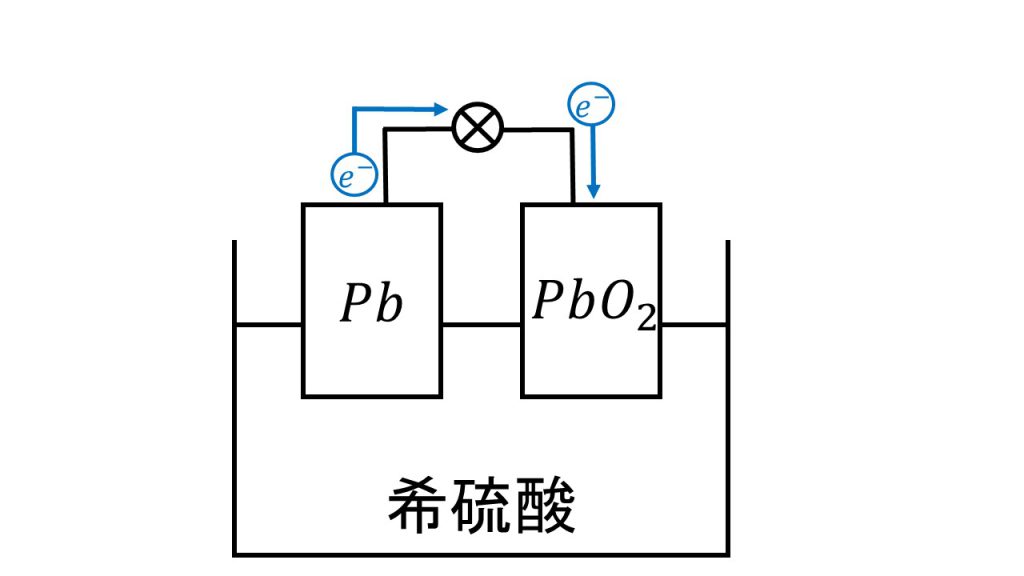
そして負極と正極の反応を考えます。今回の問題を解くのに正極の反応はいりませんが、一応書いておきます。
負極:Pb + SO42- → PbSO4 + 2e–
正極:PbO2 + SO42- +4H+ + 2e– →PbSO4 + 2H2O
流れる電子の物質量で方程式を立てる
次に求める質量を文字で置き、電池の計算の基本通り、流れる電子の物質量で方程式を立てます。

負極で消費された鉛の質量を鉛のモル質量で割ることで、負極で消費された鉛の物質量となります。そして負極の反応式を見ると、鉛と電子の係数の比が1:2なので×2をすることで、負極で放出された電子の物質量となります。
そして問題文から10Aに1時間つまり60×60秒をかけることで、今回流れた電気量つまりCを求めることができ、それをファラデー定数で割ることで、今回流れた電子の物質量となります。
そして電池では、どの場所においても電子の物質量は等しいので方程式となります。
あとは、この方程式を解いていきます。
求める文字を左辺にそれ以外を右辺に集めて、小数点を2つ動かし、約分をできるだけして、分子のかけ算をして割り算をして、有効数字が3桁となるように四捨五入をしたら、答えは38.6gとなります。
このように消費と生成の場合は、通常の電池の計算の基本通りに解くことができます。
例題②:負極の質量の増加
それでは、次にこの問題を解いてみます。
鉛蓄電池を放電させたところ、負極が放電前よりも14.4g 重くなった。では放電した電気量は、何Cか求めてみましょう。
この問題は「負極が重くなった」と書いており、電極自体の質量変化を考えているので、増減のパターンの問題であると判断することができます。こうなると通常の電池の計算とは、少し違った考え方をしないといけません。
鉛蓄電池全体の反応式を書く
まずは鉛蓄電池の反応をまとめた式を書きます。

この反応が起きるときは、電子の係数は2であることに注意しましょう。
流れる電子の物質量で方程式を立てる
そして今回は、負極の質量変化を考えているので、負極は電子が2mol流れたときSO4分つまり96g/mol増加することになります。
よって、求める電気量をQ[C]として方程式を立てるとこのようになります。

負極の増加した質量をSO4のモル質量で割ることで、負極において増加したSO4の物質量が出ます。そしてそれは、電子2molあたりなので×2をすることで電子の物質量となります。
この×2は、SO4が1mol増えたとき、電子は2mol流れるという関係なので、増加したSO4の物質量に×2をすることで電子の物質量となると考えることもできます。
そして右辺は、電気量をファラデー定数数で割ることで流れた電子の物質量とします。
あとは、方程式を解くのですが、今回は計算は省略して答えは28950Cとなります。
このように増減を考えるときは、電極あるいは電解液において何が増減しているかを考え、その物質量を求めてから電子の物質量に変換して方程式を立てるようにします。
いかがだったでしょうか。鉛蓄電池の計算には、2つの方向性があるということを理解できたと思います。ぜひ今回解説した考え方を使って問題演習をして、鉛蓄電池の計算をマスターするようにしましょう。
(3)解説授業の内容を復習しよう
(4)電池(理論化学)の解説一覧
①金属のイオン化傾向を完全に理解しよう(水との反応・酸との反応)
②電池の計算の基本(電池が成立するための条件についても解説しています)
③ダニエル電池完全解説(素焼き板の役割、起電力を大きくする方法、電池を長持ちさせる方法)
④鉛蓄電池の計算の考え方(そもそも鉛蓄電池とは何か、充電できる理由、消費・生成と増減の違いについても解説しています)
(5)参考
☆電池と電気分解(理論化学)の解説・授業・知識・演習問題一覧
☆化学の解説動画・授業動画一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識テスト一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学の解説・授業・知識・演習問題一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学の語呂合わせ(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
「化学計算の王道」シリーズは『思考訓練の場としての体系化学』(GHS予備校)を参考にしています。
GHS予備校についてはこちら→https://ghs-yobikou.co.jp/
思考訓練シリーズの購入はこちら→https://ghs-yobikou.shop/
