(1)解説授業動画
☆YouTubeチャンネルの登録をよろしくお願いします→大学受験の王道チャンネル
(2)解説授業の原稿
今回は第一イオン化エネルギーと電子親和力と電気陰性度の解説をします。これらはよく混同されてしまうので、しっかりと区別をして理解するようにしましょう。
第一イオン化エネルギー・電子親和力・電気陰性度の定義
まずはそれぞれの定義を確認します。
第一イオン化エネルギーは、気体状態の原子から電子を1つ奪い、一価の陽イオンにするのに必要なエネルギーのことです。
そして、電子親和力は、気体状態の原子に電子を1つ与えて、一価の陰イオンにしたときに放出するエネルギーのことです。
さらに、電気陰性度は、共有電子対を引きつける力の強さを数値化したものです。
これが定義です。
第一イオン化エネルギーと電子親和力の違い
次に第一イオン化エネルギーと電子親和力の違いを解説します。
第一イオン化エネルギーは電子を1つ奪うのに、必要なエネルギーです。図にすると、下図のようになります。

原子から電子を引き離すためにはエネルギーが必要であり、そのエネルギーのことを第一イオン化エネルギーと呼んでいます。
また、電子親和力は電子を与えたときに放出するエネルギーのことです。
原子に電子を与えると原子はエネルギーを放出します。その放出するエネルギーのことを電子親和力と呼んでいます。
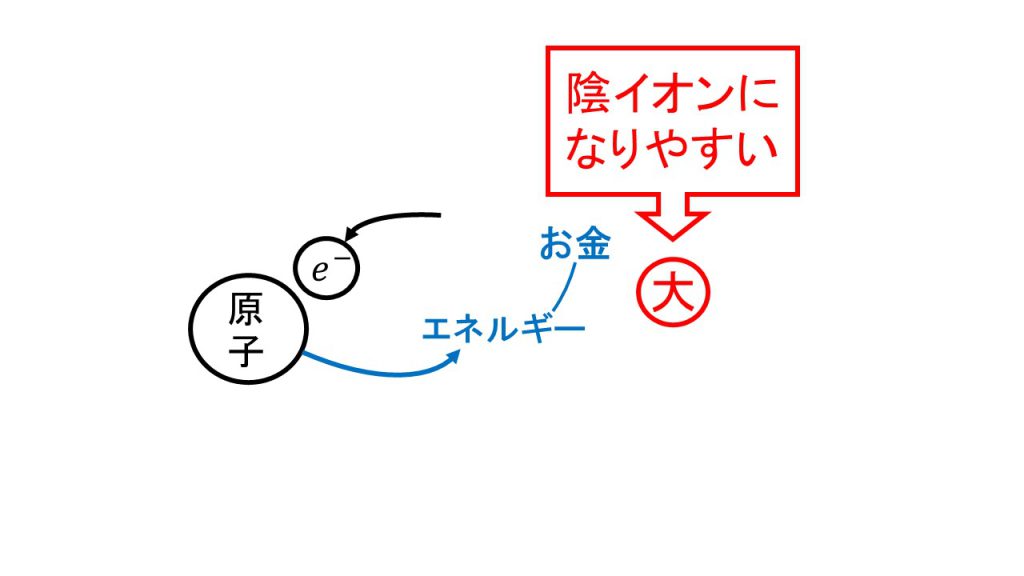
お金を使った例
このエネルギーのことをお金に例えると理解しやすくなります。
原子にとって電子は価値のあるものなので、原子から電子をもらおうと思えばお金を払わないといけないし、逆に原子に電子をあげたら、原子はお金を払ってくれます。これが原子にとっての電子とエネルギーの関係です。
そのため、陽イオンになりにくい原子は第一イオン化エネルギーが大きくなり、陰イオンになりやすい原子は電子親和力が大きくなります。
先ほどのお金の例でいえば、陽イオンになりにくい原子ということは、電子を離したがらない原子であるということなので、そういった原子から電子を買うためにはたくさんのお金が必要となります。
また、陰イオンになりやすい原子ということは、電子を受け取りやすい原子ということなので、そういった原子はたくさんのお金を払ってでも電子を買おうとします。
このように考えるとこれらの大小関係の傾向は理解しやすくなると思います。
第一イオン化エネルギーと電子親和力の大小関係は同じ
ちなみに希ガス以外においては、陽イオンになりにくいということと、陰イオンになりやすいということは、同じことを意味しています。
そのため第一イオン化エネルギーと電子親和力の大小関係は同じになる、ということが言えます。
この点については後ほど詳しく解説します。
電気陰性度とは何か
そして、電気陰性度は、共有結合しているときに、この共有電子対をひきつける力の強さを表しています。
例えば、HClつまり塩化水素においては、水素よりも塩素の方が、電気陰性度が大きいので、この共有電子対は、実際は塩素の方にひきつけられているということになります。そのため、あえてわかりやすくかくと下図のようになっています。
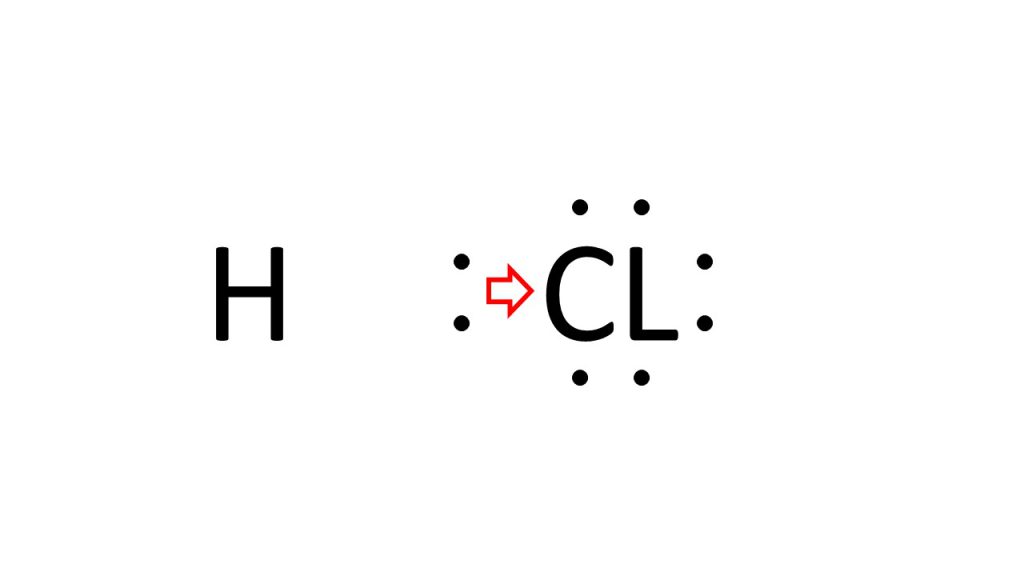
水素と塩素の共有電子対は塩素側にひきつけられているということになります。
極性とは何か
そして電子はマイナスの電気をもっているので、共有電子対がひきつけられている塩素側がマイナスの電荷を帯びるようになり、逆にマイナスの電気が離れていっている水素側は、プラスの電荷を帯びるようになります。
このような分子の中での電荷の偏りのことを極性と呼んでいます。
つまり電気陰性度は極性があるかどうか、あるいは極性が大きいか小さいかを知るために用いる数値なのです。
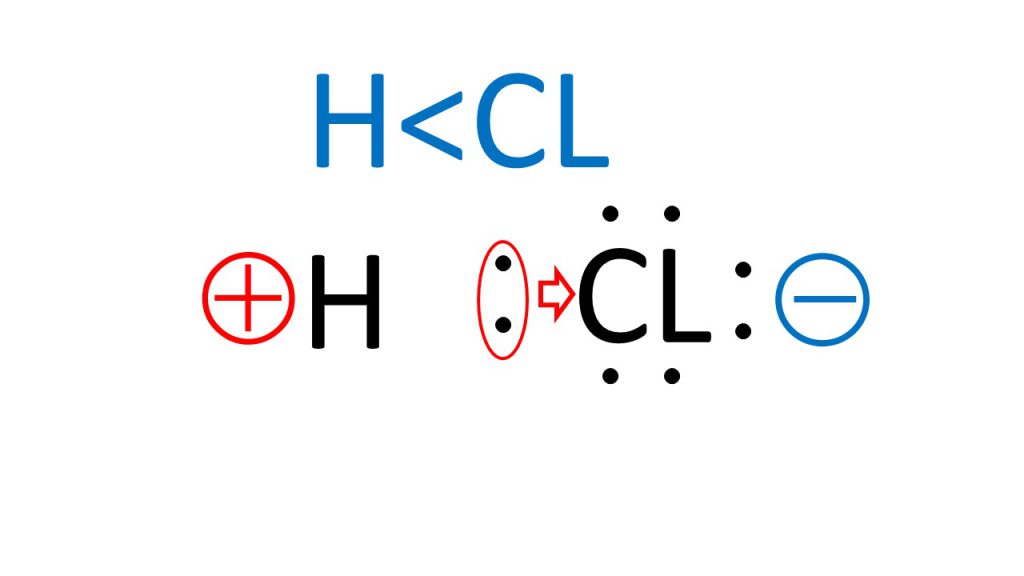
電気陰性度の大小関係の傾向
ちなみに「電気陰性度は、第一イオン化エネルギーと電子親和力を足して2で割った値と傾向が近くなる」ということは知っておきましょう。
電気陰性度の傾向=(第一イオン化エネルギー+電子親和力)÷2
もちろんこの式では正確な電気陰性度の値を求めることはできませんが、大小関係の傾向を知るのであればこの式で考えてもいいです。
ちなみになぜこの式になるかというと、第一イオン化エネルギーとは陽イオンのなりにくさ、つまり、電子を離したくない度合いを表しており、電子親和力は、陰イオンのなりやすさ、つまり、電子の受け取りやすさを表しており、そのため、どちらも電子を手元に置いておきたい力を表しているので、共有電子対をひきつける力の強さと傾向が似るのです。
いかがでしょうか。それぞれの言葉の意味が理解できたでしょうか。
陽イオンと陰イオンのなりやすさ
それでは周期表における第一イオン化エネルギーと、電子親和力と電気陰性度の大小関係について確認します。
まずはその前に、希ガスを除いた周期表における陽イオンと陰イオンのなりやすさの傾向について確認します。
同一周期(周期表の横方向)
同一周期、つまり、周期表の横における陽イオンと陰イオンのなりやすさは、左にいくほど陽イオンになりやすく、右にいくほど陰イオンになりやすい傾向があります。
それはなぜかというと、周期表の左側の元素、例えばアルカリ金属といった元素は、あと1つ電子を放出すれば、希ガスと同じ安定した電子配置になるので、電子を放出して陽イオンになりやすくなります。
また、周期表の右側の元素、例えばハロゲンといったような元素は、あとひとつ電子を受け取れば希ガスと同じ安定した電子配置になるので、陰イオンになりやすくなります。
同一族(周期表の縦方向)
また、同一族、つまり周期表の縦においては上にいくほど陰イオンになりやすく、下にいくほど陽イオンになりやすい傾向があります。
それはなぜかというと、周期表で下に降りていくということは、電子殻の数が増えていくということなので、それだけ最外殻と原子核の距離が遠くなるということになるからです。
つまり、原子核に近づけば近づくほど、原子核が電子を引きつける力が強くなるので、電子を受け取りやすくなり、逆に、原子核から離れれば離れるほど電子を引きつける力が弱いので、電子を放出しやすくなるのです。
周期表における大小関係
まず、こういった一般的な傾向を抑えた上で、第一イオン化エネルギーと電子親和力と電気陰性度を考えてみます。
第一イオン化エネルギー
先ほども確認した通り、第一イオン化エネルギーは陽イオンのなりにくさを表しているので、陽イオンになりやすい左下が小さくなり、逆に右上にいくほど陽イオンになりにくいので、第一イオン化エネルギーは右上にいくほど大きくなります。
そして希ガスは安定しているので、そこから電子を奪うにはとても大きなエネルギーが必要となります。そのため第一イオン化エネルギーの最大は、一番右上の希ガス、つまりヘリウムとなります。
電子親和力
続いて、電子親和力は、陰イオンのなりやすさを示しているので、右上にいくほど大きくなります。
ただし、注意したいのが、希ガスは安定しているため、これ以上電子を受け取りたくないので希ガスの電子親和力は負の値となります。希ガスは電子を受け取りたくないということを表しています。
そして電子親和力の最大は、希ガスを除いた右上、つまりフッ素、ではなく塩素となります。
この理由はフッ素自体がもっている電子が、新たな電子を受け取るのを邪魔してしまうからです。そしてこの影響はそれほど大きいものではないので、最大は確かに塩素ですが、その差はわずかであり、フッ素の電子親和力は二番目に大きい値となっています。
電気陰性度
そして電気陰性度ですが、大小関係の傾向を知るためには、第一イオン化エネルギーと電子親和力を足して2で割ればいいので、電気陰性度もこの2つと同じ、右上にいくほど大きくなります。
ただし、希ガスは共有結合をしないので、希ガスの電気陰性度は考えないようにします。すると、電気陰性度の最大はフッ素となります。
また、ついでに覚えておいてほしいのが、電気陰性度が二番目に大きい元素は酸素となります。
フッ素や酸素など電気陰性度が大きい元素を含んでいる分子は、極性が大きくなりやすく、水素結合を形成するものとして知っておきましょう。
いかがだったでしょうか。第一イオン化エネルギーと電子親和力と電気陰性度は、その言葉の意味を正確に把握し、イオンと電子の関係を理解した上で、その大小関係の傾向を考えるようにしましょう。
(3)解説授業の内容を復習しよう
(4)原子の構成・化学結合(化学基礎)の解説一覧
②第一イオン化エネルギー・電子親和力・電気陰性度の解説(周期表における大小関係も解説しています)
(5)参考
☆化学の解説動画・授業動画一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識テスト一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学の解説・授業・知識・演習問題一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
