(1)解説動画
- 元動画①→ダニエル電池完全解説(ボルタ電池の問題点(分極)、素焼き板の役割、起電力を大きくする方法、電池を長持ちさせる方法についても解説しています)
- 元動画②→鉛蓄電池の計算の考え方(そもそも鉛蓄電池とは何か、充電できる理由、消費・生成と増減の違いについても解説しています)
☆YouTubeチャンネルの登録をよろしくお願いします→大学受験の王道チャンネル
(2)解説授業の原稿
ボルタ電池の正極と負極の反応式
ボルタ電池は、下図のように電極に亜鉛と銅を使い、電解液に希硫酸を使った電池です。
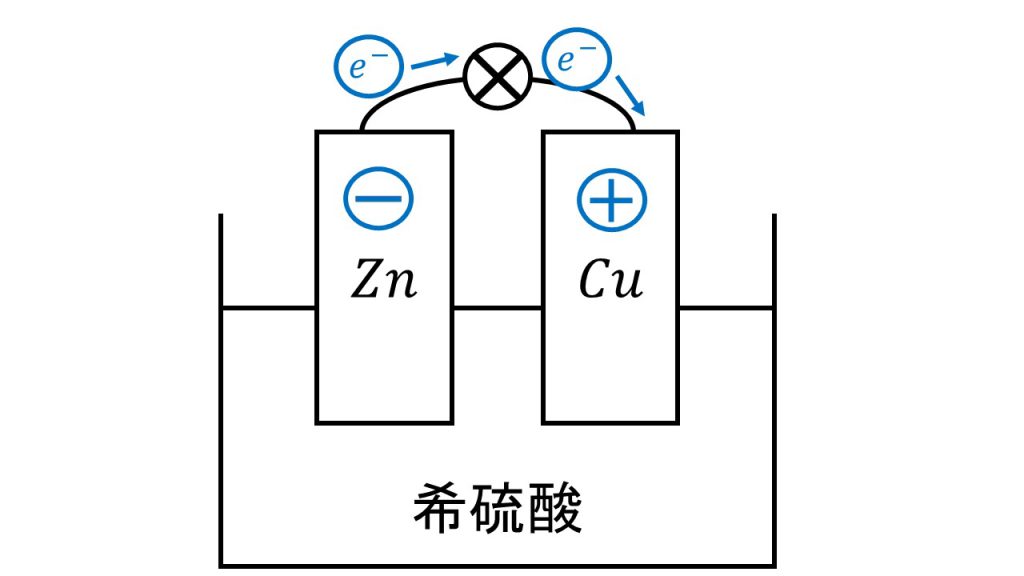
亜鉛と銅のイオン化傾向を比べると亜鉛の方が大きいので、亜鉛が電子を放出し、銅は電子を受け取ります。そのため亜鉛が負極となり、銅は正極となります。
ボルタ電池において、負極と正極で以下のような反応が起きています。
負極:Zn → Zn2+ + 2e–
正極:2H+ + e– → H2
負極では亜鉛が酸化されて亜鉛イオンとなり、電子を放出します。そして正極では、水素イオンが還元されて水素となります。
正極で注意したいのは、銅イオンが還元されて銅になるといった反応(Cu2+ + 2e– → Cu)は起きないということです。なぜなら電解液の中に銅イオンは存在しないからです。電解液は希硫酸であり、硫酸は水溶液中で水素イオンと硫酸イオンに電離します。そのため正極で還元されるのは水素イオンで、発生するのは水素です。
ダニエル電池の正極と負極の反応式
ダニエル電池は下図のような電池で、電極を亜鉛と銅にし、電解液を素焼き板で区切って亜鉛側を硫酸亜鉛水溶液、銅側を硫酸銅水溶液とした電池です。
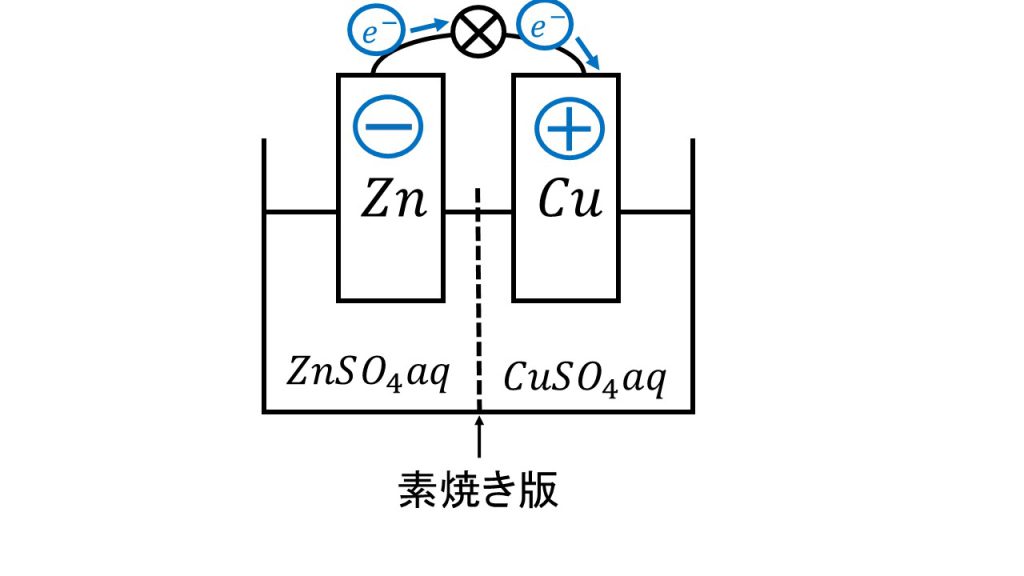
ちなみに、この 「aq」は「aqua」の略で、水溶液であるということを表しています。また、「素焼き」とはただ粘土をこねて焼いただけのもので、植木鉢などが素焼きの代表例です。
このようにダニエル電池は電解液に硫酸を使いません。そのため正極で水素が発生しないので、分極が起きないのです。
鉛蓄電池の正極と負極の反応式
鉛蓄電池とは、下図のように負極に鉛、正極に酸化鉛を使い、電解液を希硫酸とした電池のことです。
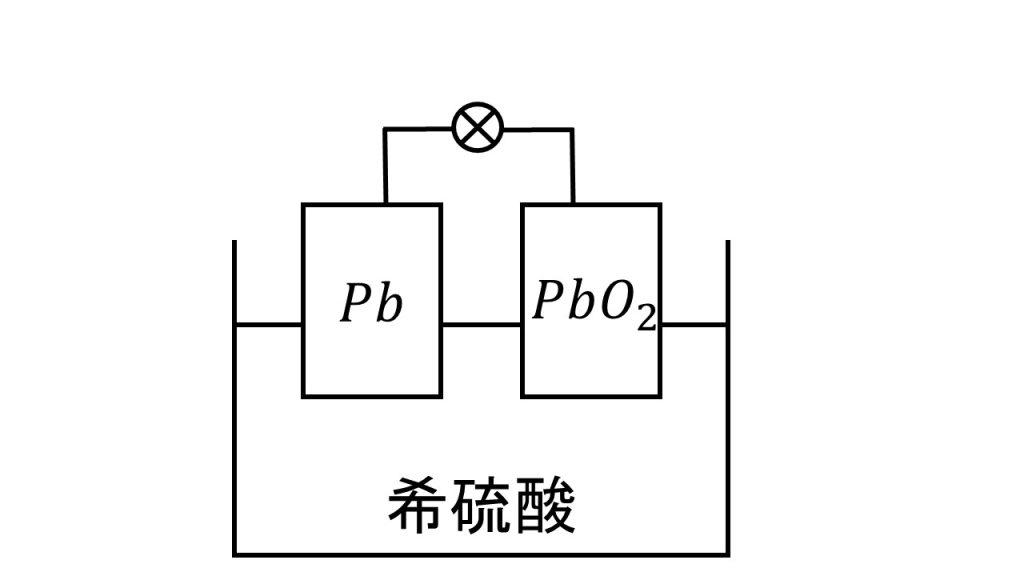
鉛畜電池の負極と正極の反応は、反応物と生成物だけ覚えておけば、残りの部分は酸化還元反応の半反応式の作り方で作ることができます。
- 半反応式の作り方の詳しい解説はこちら→酸化還元反応の化学反応式の作り方(硫酸酸性の過マンガン酸カリウムと硫酸鉄(Ⅱ)の反応)
実際にやってみましょう。
負極における反応物は鉛で、生成物は硫酸鉛です。まずは、両辺のSの数を揃えるために左辺に硫酸イオンを追加します。次に鉛の酸化数の変化を確認すると0から+2に増加しており、これは電子を2つ放出したという意味なので、右辺に電子を2つ加えます。これで両辺の原子の数も電価の数も揃ったので負極の反応式が完成しました。
負極:Pb + SO42- → PbSO4 + 2e–
続いて正極です。まずは、両辺のSの数を揃えるために、左辺に硫酸イオンを加えます。そして次に、鉛の酸化数の変化を確認すると+4から+2に減少しており、これは電子を2つ受け取ったということなので、左辺に電子を2つ加えます。そして次に、両辺の電価の合計を確認してみると、左辺は-2と-2で合計-4であり、右辺は0なので、電価を両辺でつり合わせるために左辺に水素イオンを4つ加えます。そして最後に両辺のHとOの数をそろえるために、右辺にH2Oを2つ加えて正極の反応式が完成しました。
正極:PbO2 + SO42- +4H+ + 2e– →PbSO4 + 2H2O
(3)解説授業の内容を復習しよう
(4)化学反応式の王道(電池と電気分解)の解説一覧
【電池の反応式】
①電池の負極と正極の反応式(ボルタ電池、ダニエル電池、鉛蓄電池)
【電気分解の反応式】
(5)参考
☆電池と電気分解(理論化学)の解説・授業・知識・演習問題一覧
☆化学の解説動画・授業動画一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識テスト一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学の解説・授業・知識・演習問題一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学の典型パターン一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
