(1)例題
下図に示すように、シャーレに食塩水で湿らせたろ紙を敷き、この上に表面を磨いた金属板A~Cを並べた。次に、検流計の端子Ⅰ(左側)と端子Ⅱ(右側)をそれぞれ異なる金属板に接触させ、検流計を流れた電流の向きを記録すると表のようになった。金属板A~Cが銅、亜鉛、マグネシウムのいずれかであるとしたとき、金属板A~Cがそれぞれ何か答えよ。
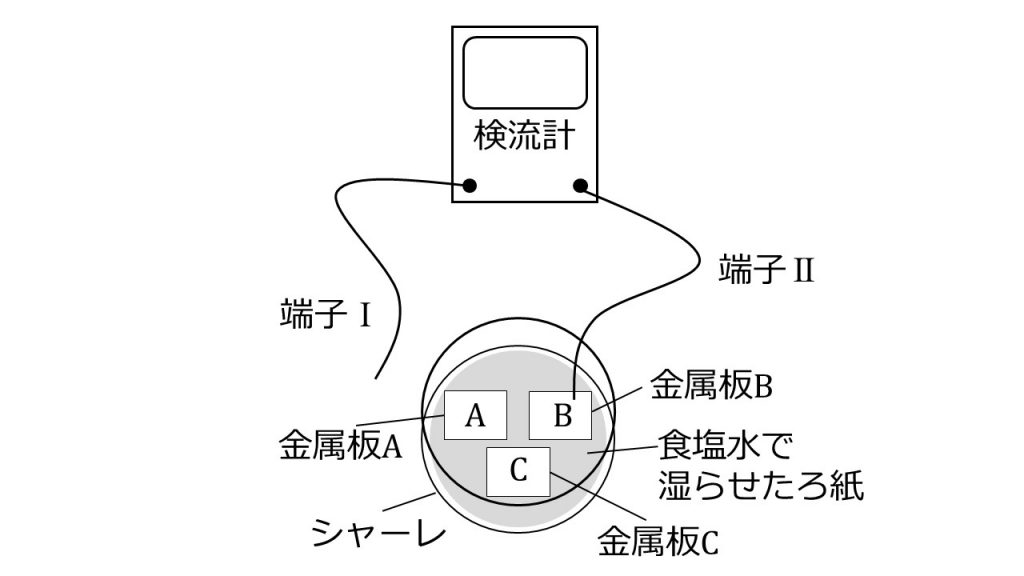
| 端子Ⅰ側の金属板 | 端子Ⅱ側の金属板 | 検流計を流れた電流の向き |
| A | B | BからA |
| B | C | BからC |
| A | C | AからC |
(2017年センター試験本試化学第3問問6)
(2)例題の答案
電池において、正極では還元反応、負極では酸化反応が生じているから、イオン化傾向が大きい方の金属が負極、小さい方の金属が正極となる。
よって表から、イオン化傾向は
C>A>B
となるので、
Aが亜鉛、Bが銅、Cがマグネシウム
(3)解法のポイント
電池の正極と負極は、金属のイオン化傾向の大小によって決まります。
(4)理解すべきこと
☆金属のイオン化傾向と、電子の動き、酸化還元反応、正極負極の関係を理解しましょう→金属のイオン化傾向を完全に理解しよう(水との反応・酸との反応)
(5)参考
☆化学の解説動画・授業動画一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
