(1)解説授業動画
☆YouTubeチャンネルの登録をよろしくお願いします→大学受験の王道チャンネル
(2)解説授業の原稿
今回は結晶水を持つ固体の溶解について解説します。
結晶水を持つ固体の代表例は、硫酸銅五水和物です。硫酸銅五水和物が、問題でもよく使われるので、今回は硫酸銅五水和物で解説します。
硫酸銅五水和物の性質
まずは、硫酸銅五水和物の性質を確認します。
硫酸銅五水和物とは硫酸銅と水が1:5の割合で集まった結晶です。結晶の中に含まれている水分子のことを結晶水または水和水と言います。
硫酸銅五水和物を水に溶かす
そして下図のように、水を含んだ結晶を水に溶かしてみると、硫酸銅と水はバラバラに分かれます。

つまり、溶液の中の溶質は、硫酸銅五水和物ではなく、ただの硫酸銅である、ということになります。
硫酸銅の結晶を取り出す
次に、硫酸銅を含む溶液から硫酸銅の結晶を取り出そうとすると、どうなるか考えてみます。
硫酸銅は、結晶となるときは基本的に硫酸銅五水和物となるので、周りにある水分子を取り込んで結晶となります。
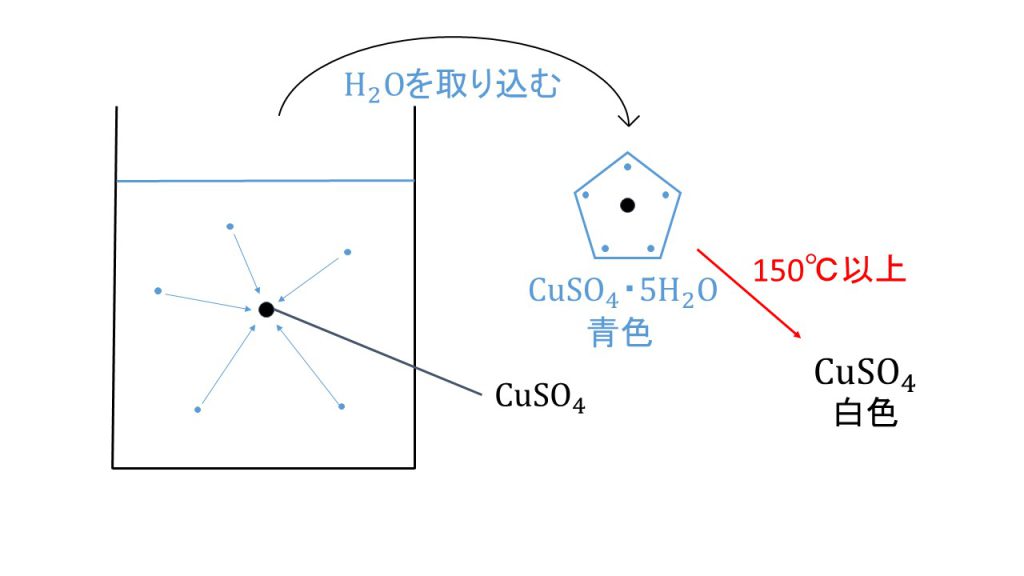
図のように、硫酸銅五水和物は水に溶けたときは結晶水を放し、溶液から結晶となるときは水を取り込む、という性質を持っているのです。
ちなみに、硫酸銅五水和物は青色の結晶で、150℃ 以上で加熱すると、白色の硫酸銅無水塩となるということは知っておきましょう。
硫酸銅五水和物を使った計算のポイント
それでは硫酸銅五水和物を使った計算のポイントを確認します。
CuSO4の式量を160、H2Oの分子量を18としたとき、CuSO4・5H2Oの式量は250となります。
硫酸銅五水和物を水に溶かしたとき
それを踏まえて、硫酸銅五水和物をaグラム、硫酸銅水溶液に溶かしたらどうなるか考えてみます。
まず溶質は硫酸銅のことであり、硫酸銅五水和物の硫酸銅の部分が増えるので、a×160/250グラムだけ溶質は増えるということになります。
また、溶媒は水のことであり、硫酸銅五水和物のうちの水の部分が増えるということなので、溶媒はa×90/250グラムだけ増えるということになります。90というのは18×5のことです。
先程も確認した通り、硫酸銅五水和物は水に溶けると硫酸銅と水に分かれるので、このように溶質と溶媒が両方とも増えるということになります。
そして、溶液は合計のaグラム増えるということになります。
硫酸銅五水和物を析出させるとき
それでは次に、硫酸銅水溶液から硫酸銅五水和物をbグラム析出するとどうなるか考えてみます。
まず溶質は硫酸銅のことなので、b×160/250グラム減少します。そして、溶媒は水のことなので、b×90/250グラム減少します。
硫酸銅の性質により、結晶として析出するときは周りの水を取り込んで析出するので、溶質だけでなく溶媒も減少することになります。
そして溶液は合計bグラム減少します。
このように硫酸銅五水和物の溶解や析出を扱った問題は溶質と溶媒の両方が変化するということに注意しましょう。
問題①:硫酸銅五水和物を水に溶かす
それでは硫酸銅五水和物の溶解を扱った計算問題を解いてみます。
なお溶解度の計算の基本は別の動画で解説しているので、もし溶解度の計算の基本が身についていない場合は、まずそちらをご覧になってください。
今回、硫酸銅の式量は160で水の分子量は18とします。また有効数字は3桁で答えます。まずは以下の問題を解きます。
硫酸銅の溶解度は25℃で23.2である。25℃で硫酸銅五水和物の結晶は水100gに最大で何g溶けるか、求めてみましょう。
溶質・溶媒・溶液の表を作る
まずは、求める硫酸銅五水和物の結晶の質量をx[g]とおきます。
そして今回「最大で」とあるので、飽和溶液にすると考えて、溶質、溶媒、溶液の表を作ります。
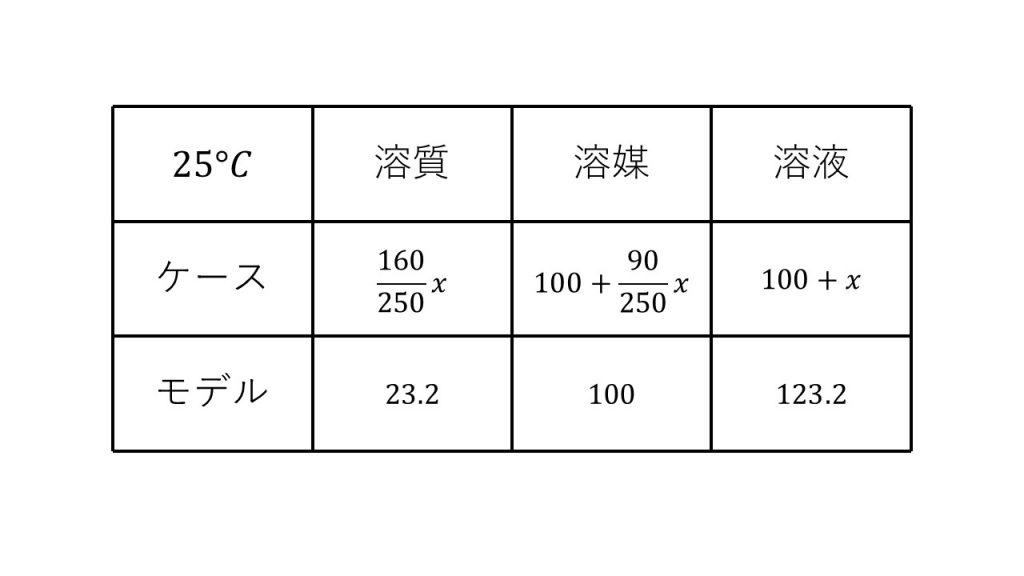
まずは、モデルの溶質は溶解度なので23.2で、溶媒は100です。そして溶液は23.2+100の123.2となります。
次に、今回の溶質ですが、x×160/250となります。先程も確認した通り、硫酸銅五水和物の結晶をxグラム溶かした場合、硫酸銅五水和物のうちの硫酸銅の部分が溶質となるので、x×160/250だけ溶質が増えるのです。
そして、溶媒は、もともとあった水100グラムに硫酸銅五水和物の結晶から出てくる結晶水を加えます。そのため100+x×90/250グラムとなります。
そして最後に溶液は、もともとあった100グラムに合計xグラムを足した100+xグラムとなります。
このように、硫酸銅五水和物を水に溶かすときは、溶質と溶媒の両方が増加するということに注意しましょう。
方程式を立てて解く
これで溶質、溶媒、溶液の表ができたので方程式を作ります。今回は溶質と溶媒で、方程式を作ります。
それでは、この方程式を解いていきます。
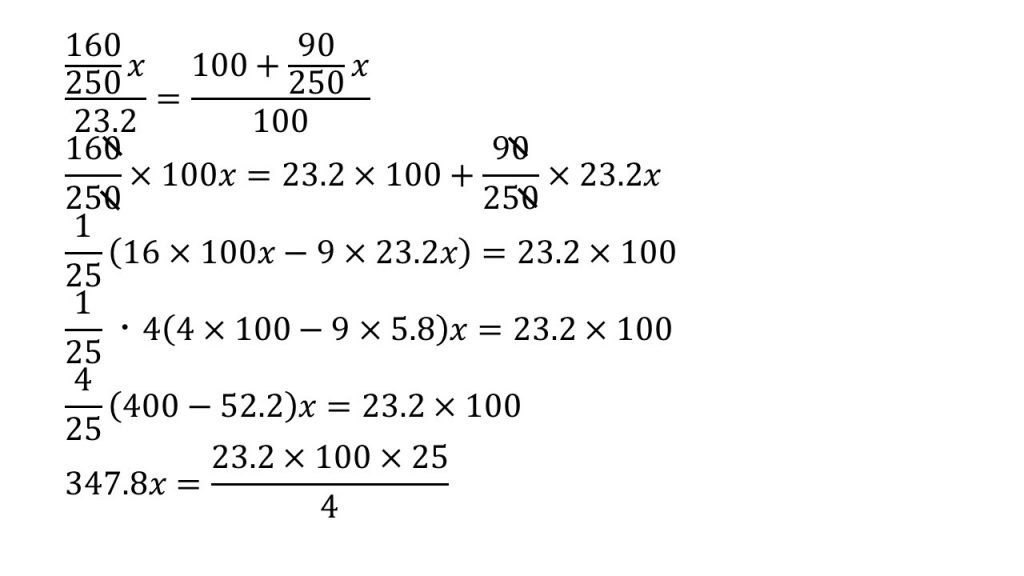

まずは両辺の分母をはらいます。そして簡単に約分できるところは、約分をしていきます。 そしてxを含む項を左辺に、それ以外を右辺にします。
次に、分母の25が計算しにくいので、両辺を25倍します。ここは25×4は100なので、100としておきました。
次に、この方程式を簡単にすることを考えて、16と23.2が8で割り切れるので、両辺を8で割ります。
そして、これ以上は簡単にできそうにないので、左辺を計算します。その後、両辺を173.9で割り、これ以上約分はできそうにないので、分子の掛け算をして、最後に割り算をし、有効数字3ケタとなるように四捨五入をして、答えは41.7gとなります。
このように、硫酸銅五水和物の計算は複雑になりやすいので、なるべく簡単になるように工夫をしながら計算をして行きましょう。
問題②:硫酸銅五水和物を析出させる
それでは次に、この問題を解いてみます。
30℃における硫酸銅の飽和水溶液200gをとり、水50gを蒸発させた後、再び30℃に戻して放置すると、何gの硫酸銅五水和物の結晶が析出するか。ただし、硫酸銅の溶解度は30℃で25である。
この問題では、最初の状態で飽和水溶液であると書いてあります。また、「水を蒸発させ、再び温度を戻した後に結晶が析出する」とあるので、この状態でも飽和水溶液であると判断できます。
最初の状態の溶質、溶媒、溶液の表を作る
まずは最初の状態の飽和水溶液の溶質、溶媒、溶液の表を作ります。
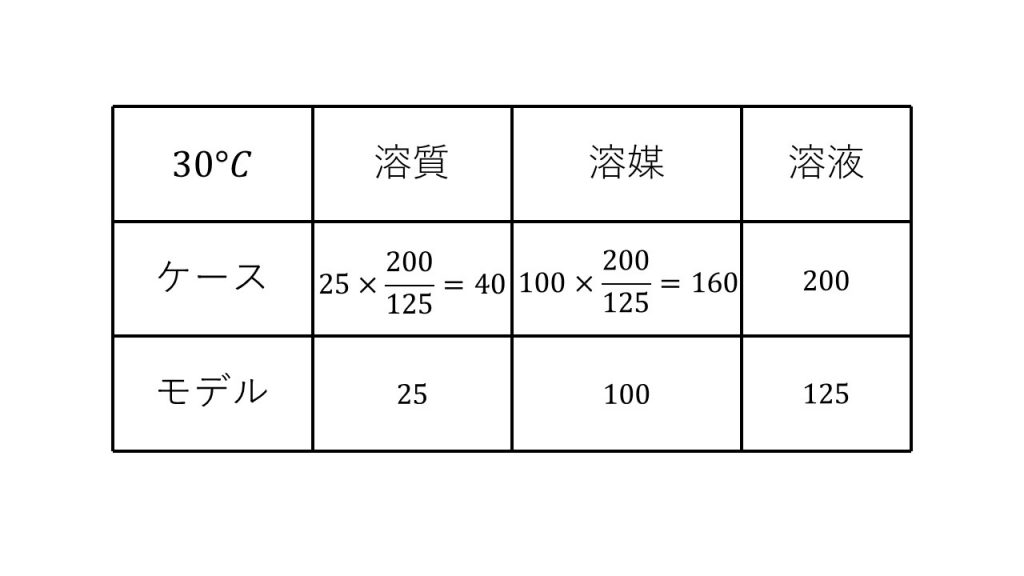
モデルの溶質は溶解度の25です。溶媒は100で、溶液は25+100の125です。
そして今回、飽和水溶液が200グラムであり、ケースはモデルを200/125倍しているものなので、溶質は25×200/125で、溶媒は100×200/125となります。それぞれ簡単に計算ができるので、先に計算をしておきます。
これで最初の状態の溶質と溶媒と溶液の質量がわかりました。
後の状態の溶質、溶媒、溶液の表を作る
これらを使って、後の状態の表を作ります。
求める質量、つまり析出する硫酸銅五水和物の結晶の質量をx[g]とおきます。そして、この飽和水溶液の溶質、溶媒、溶液の表を作ります。
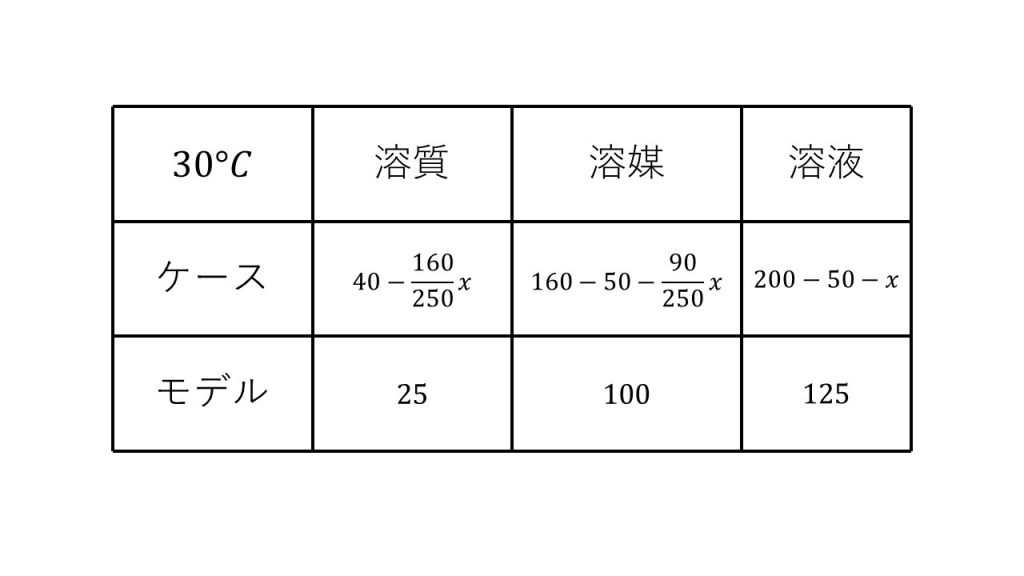
まず溶質は、もともとあった40gから硫酸銅五水和物の硫酸銅の部分が減るので40-x×160/250となります。
次に溶媒は、もともとあった160gから蒸発させた50gと硫酸銅五水和物が結晶となるときに、一緒に連れて行く水の分を引きます。そのため160-50-x×90/250となります。
そして溶液は、もともとあった200gから、蒸発させた水と析出した硫酸銅五水和物の結晶を引いた200-50-xとなります。
このように硫酸銅五水和物の結晶が析出するときは、溶質と溶媒の両方が減少するということに注意してください。
方程式を立てて解く
これで析出した後の飽和水溶液の溶質、溶媒、溶液の表ができたので、あとは方程式を立てて解きます。
今回は溶質と溶液で方程式を立てます。
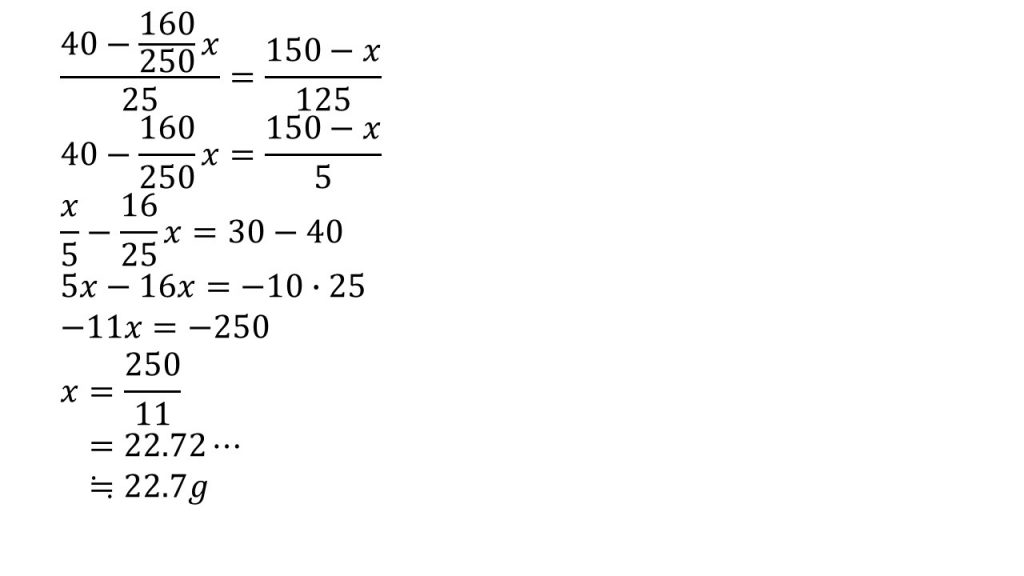
それでは方程式を解いていきます。
まずは両辺を25倍します。そして簡単に約分できるところは、約分しておきます。
次にxを含む項を左辺、それ以外を右辺に集めます。そして分母をはらうために、両辺を25倍します。
左辺は計算して、右辺はくくり出せるだけくくり出します。
そして右辺を計算してxについて解き、割り算をして有効数字3ケタとなるように四捨五入したら答えが22.7gとなります。
いかがだったでしょうか。硫酸銅五水和物の計算の流れが理解できたでしょうか。硫酸銅五水和物の結晶を溶かす、あるいは硫酸銅五水和物の結晶を析出させる、どちらにしても溶質と溶媒の両方に変化があるということに注意しましょう。
(3)解説授業の内容を復習しよう
(4)溶解度の計算の解説
①溶解度の計算の基本(溶質・溶媒・溶液の表を使った計算の方法を解説しています)
②結晶水をもつ固体(硫酸銅(Ⅱ)五水和物)の溶解の計算(硫酸銅(Ⅱ)五水和物の性質についても解説しています)
(5)参考
☆化学の解説動画・授業動画一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識テスト一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学の解説・授業・知識・演習問題一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学の語呂合わせ(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
「化学計算の王道」シリーズは『思考訓練の場としての体系化学』(GHS予備校)を参考にしています。
GHS予備校についてはこちら→https://ghs-yobikou.co.jp/
思考訓練シリーズの購入はこちら→https://ghs-yobikou.shop/
