(1)解説授業動画
☆YouTubeチャンネルの登録をよろしくお願いします→大学受験の王道チャンネル
(2)解説授業の原稿
今回は物質量を正しく理解していないと解けない問題の解説をします。
さっそく問題を確認してみます。
問題
硫酸カリウム35g中にカリウム原子が何個あるかを求めてみます。ただし有効数字は2桁で答えます。
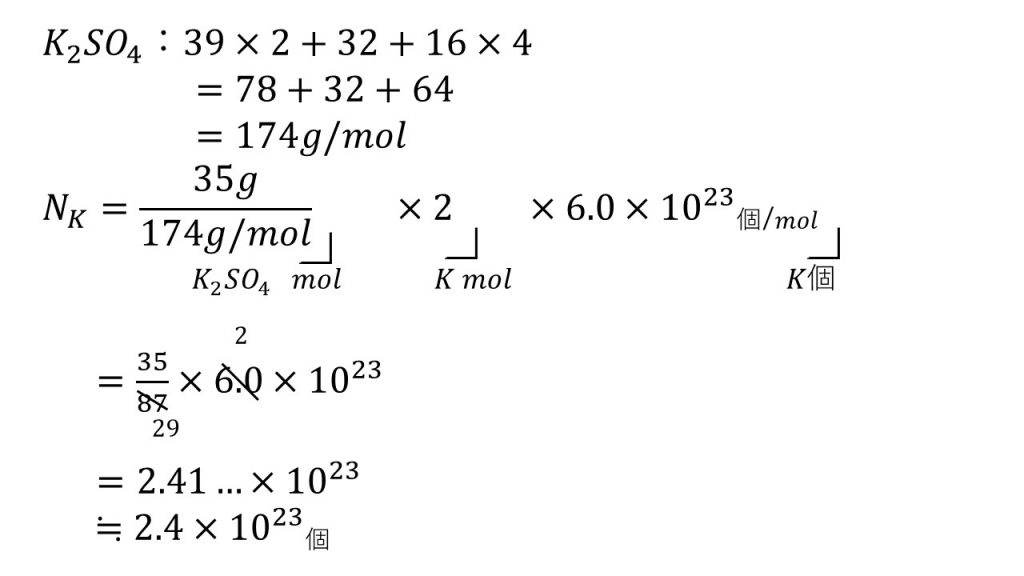
硫酸カリウムの物質量(mol)を求める
こういった問題は、とりあえず物質量(mol)を求めてみます。
そのために硫酸カリウムのモル質量を求めます。硫酸カリウムはK2SO4なので、それぞれの原子量から硫酸カリウムのモル質量は174g/molとなります。
よって硫酸カリウムのモルを求めてみると、35g÷174g/molとなります。
まずこれで硫酸カリウムの物質量となります。そこまでで何が出ているのかをメモしながら式を作っていきます。
カリウムの物質量(mol)を求める
次に、求めるものはカリウムの個数なので、×2をしてカリウムの物質量とします。
ここで×2ができるかどうかが今回のポイントとなります。この×2については後ほど詳しく解説します。
カリウムの個数を求める
まずは式を完成させます。
ここまででカリウム原子のモルが出たので、モルを個数に変換するためにアボガドロ定数つまり6.0×1023個/molをかけます。こうすることでカリウム原子のモルが、カリウム原子の個数となり、これが求めるものです。
あとは計算するのですが、まずは約分をできるだけしていきます。
約分が終わったらまず掛け算をして、最後に割り算をし、有効数字2桁となるように四捨五入をして答えとなります。
なぜ×2なのか?
では、この×2の意味を考えていきます。
よくある間違いとして、硫酸カリウムの式量が174で、カリウムが2個あるから39×2の78ということで、×78/174をしてしまったり、K2SO4は原子が7個あり、そのうちKが2個あるので×2/7をしたりするのはどちらも間違いです。
そもそも物質量(mol)とは何か?
この問題を解くときに、これらが式に含まれている場合は、物質量というものを正しく理解していないということになります。
そもそも物質量とは、原子や分子などの粒子が6.0×1023個集まったものを1molとおいたものです。
つまりモルはあくまで個数を表したものであり、質量つまりグラムとは全くの別物であるということです。
硫酸カリウム分子をセットであると考える
それではなぜ×2のなのでしょうか。
それは硫酸カリウムつまりK2SO4を、K2個、S1個、O4個のセットであると考えれば理解できると思います。
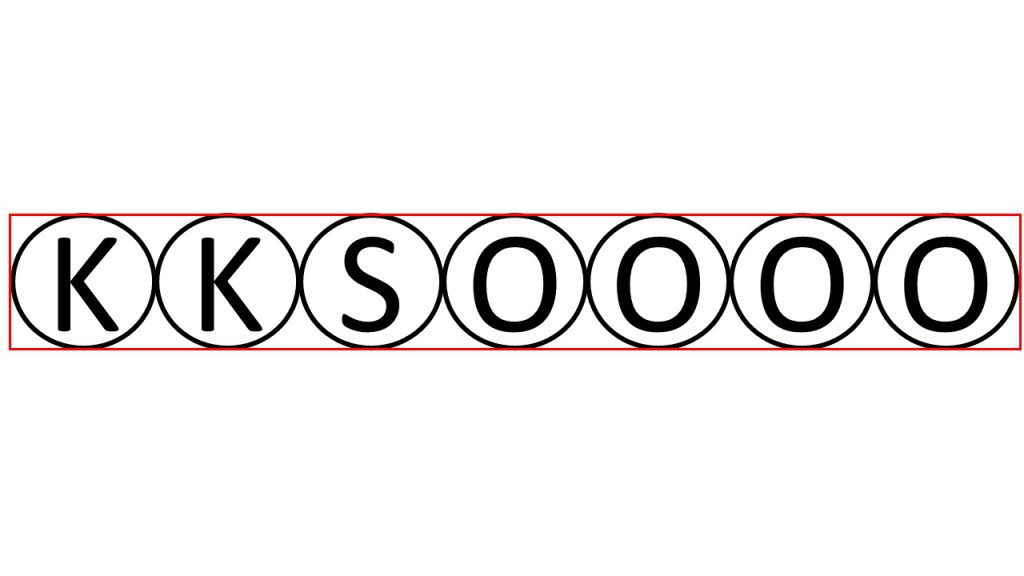
つまりK2SO4のセットが1セットあるとき、その中にカリウムの粒は2つ入っています。
例えば、K2SO4のセットが5セットあれば、カリウムの粒は10個あり、K2SO4の10セットあれば、カリウムの粒は20個あるということになります。
同様にして考えると、K2SO4のセットが35/174セットある場合は、カリウムの粒は35/174×2個あるということになるので、硫酸カリウムの物質量を2倍することで、カリウムの物質量を求めることができるのです。
いかがだったでしょうか。物質量つまりモルはあくまで個数を表してものあるということ、そしてセットで考えるということ、この2つを理解することができればこういった問題も解けるようになります。
(3)解説授業の内容を復習しよう
(4)物質量(mol)を使った計算
①物質量(mol)を使った計算(理科の計算の原則と、計算の工夫の仕方についても解説しています)
③気体の分子量を求める問題の解説(比重とは何かについても解説しています)
(5)参考
☆化学の解説動画・授業動画一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識テスト一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学の解説・授業・知識・演習問題一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学の語呂合わせ(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
「化学計算の王道」シリーズは『思考訓練の場としての体系化学』(GHS予備校)を参考にしています。
GHS予備校についてはこちら→https://ghs-yobikou.co.jp/
思考訓練シリーズの購入はこちら→https://ghs-yobikou.shop/
