(1)解説授業動画
☆YouTubeチャンネルの登録をよろしくお願いします→大学受験の王道チャンネル
(2)解説授業の原稿
ヘンリーの法則とは
まずはそもそもヘンリーの法則とは何かについて確認します。
ヘンリーの法則とは、「一定温度では一定量の溶媒に溶ける気体の質量は圧力に比例する」という法則です。
まず注意したいのは、気体を溶媒に溶かすときの法則がヘンリーの法則です。
そして、水などの溶媒に気体を溶かすときは、圧力をかければかけるほどよく溶けるというのがヘンリーの法則です。
気体の溶解度と温度
また、気体の溶解について知っておかないといけないのは、「温度を下げると気体の溶解度は増加する」ということです。
つまり気体を水などの溶媒に溶かすときは、温度を下げれば下げるほどよく溶けるということです。逆に温度を上げると、気体は水などの溶媒に溶けにくくなるということになります。
コーラは冷やした方が炭酸が強くなるのは、これが理由です。つまり冷やせば冷やすほど二酸化炭素がよく溶けて炭酸が強くなるのです。
ちなみに温度と気体の溶解度の関係は、高校の物理では計算することはありません。そのため、このことは知識として知っておくようにしましょう。
ヘンリーの法則を計算に利用する
それではヘンリーの法則に話を戻します。
ヘンリーの法則は比例関係なので計算することができます。ただ、上記のままだと計算で使いにくいので、計算で使いやすくなるようにヘンリーの法則の文を読みかえます。
ヘンリーの法則を実際の計算問題で使うときは、
「一定温度では溶媒に溶ける気体の物質量は分圧に比例し、溶媒の体積にも比例する」
と考えると計算がやりやすくなります。
ポイントは質量ではなく物質量とすること、気体は混合気体の場合があるので溶解する気体の分圧で考えるということ、そして、水など溶媒の体積が変わることもあるので溶媒の体積を計算に組み込むこと、この3点に注意しましょう。
質量ではなく物質量としたのは、基本的に化学の計算は物質量つまりmolを基準とすることが多いので、物質量で考えた方が計算がしやすくなるからです。
この文が意味していることはある意味当然のことで、気体を水などの溶媒に溶かそうと思えば圧力をかけた方がよく溶けるし、溶媒の量が多ければ多いほどを気体が溶ける量も多くなるということを意味しています。
ここまでは教科書や参考書などに書いてあることで、必ず知っておかないといけないことです。
ただヘンリーの法則の学習に関して1つ問題点があり、それはこの関係を示す計算公式が教科書や参考書に書いていないということです。つまり計算をしようとしても、使うべき計算公式がないので問題文から比例関係を読み取り、比の式などをつくって対応するという解法が一般的になっています。
ただそれは遠回りなやり方だと思います。そこで今回は「計算公式を自分で作って計算してしまう」というやり方をご紹介します。なおこのやり方は教科書や参考書には書いていないので注意してください。
教科書には書かれていないヘンリーの法則の計算公式
それでは教科書には書いていないヘンリーの法則の計算公式をご紹介します。以下がそのヘンリーの法則の計算公式です。
n=h×P×Vば
nは溶ける気体の物質量であり、hは比例定数です。そしてPは気体の分圧で、Vは溶媒の体積です。
つまりこの式は先ほど確認したヘンリーの法則を読みかえた文をそのまま式にしたものです。「溶ける気体の物質量は、気体の分圧と溶媒の体積に比例する」という意味の式となっています。ただし、この式は正式に使える式ではないので比例定数に名前がついていません。
ヘンリーの法則の計算公式の使い方
ではこの式はどのように使うのかというと、以下の手順で使ってヘンリーの法則の計算問題を解きます。
ⅰ)まずは問題文を読み、比例定数を求めるところから始めます。繰り返しになりますが、この比例定数は自分で作ったものなので、自分でその値を求めないといけません。問題文を読み、溶かそうとしている気体が1Paで溶媒1Lに何mol溶けるかを求めます。
ⅱ)そして比例定数を求めることができたら、あとはこの公式にそれぞれ値を代入して方程式を立てて問題を解いていきます。
これがヘンリーの法則の計算公式と使い方です。それでは実際にこれらを使って問題を解いてみましょう。
例題の確認
それではヘンリーの法則の計算問題を解いていきます。
酸素と窒素が21%と79%の体積比で混合した気体があります。0℃、1.0×105Paの下では1Lの水に酸素は49mL溶け、窒素は23mL溶けるとします。また酸素の分子量は32、窒素の分子量は28とし、有効数字2桁で答えます。
このような問題設定に対して3つの小問があります。
- 標準状態でこの混合気体と接している水1Lに溶けている酸素は、標準状態に換算すると何mLか求めてみます。
- 標準状態でこの混合気体と接している水1Lに溶けている窒素は何mgか求めてみます。
- 標準状態でこの混合気体と接している水1mL中に酸素分子は何個存在するか求めてみます。
この3つの問題を先ほどの計算公式を使って解いてみましょう。
それでは答案を作っていきます。
比例定数を求める
各小問を解く前に、まず比例定数を求めることから始めます。
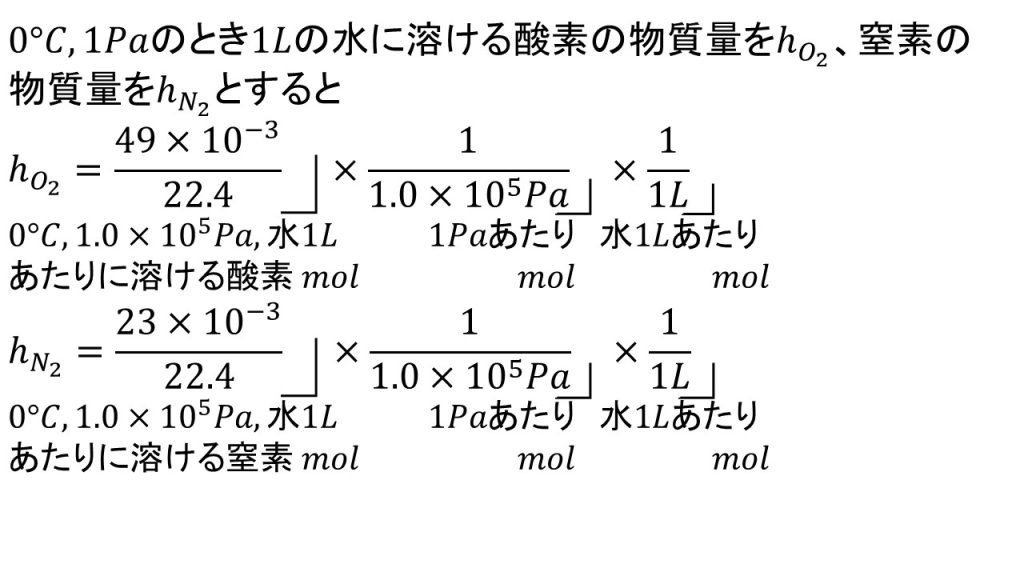
ヘンリーの法則の比例定数を求めるときはいきなり式を書くのではなく、「0℃、1Paのとき1Lに溶ける酸素の物質量をho2、窒素の物質量をhN2とする」といったような記述を先に書くようにします。ヘンリーの法則の比例定数は正式なものではなく、自分で勝手に作っているものなので記述答案で使う場合は、まずその説明を書くようにしてください。
それでは酸素と窒素のそれぞれの比例定数を求めてみます。
①酸素の比例定数を求める
まず問題文で与えられている条件を確認します。0℃、1.0×105Paつまり標準状態で酸素は49mL溶けたので、このときの酸素の物質量を求めます。
標準状態なので22.4L/molを使い、49×10-3/22.4が1.0×105Paで水1Lに溶ける酸素の物質量です。それを1.0×105Paで割ることで、1Pa、水1Lあたりに溶ける酸素の物質量となり、さらにそれを水の体積で割ることで比例定数となります。今回は水の体積が1Lなので計算的には変わることはないのですが、一応書いておきます。
このように問題文から比例定数つまり1Pa、水1Lあたりに溶ける酸素の物質量を求めることができます。
なおこの49×10-3/22.4の部分を状態方程式を使って書くこともできます。今回は小問がすべて標準状態だったので22.4L/molを使いましたが、標準状態ではない気体を扱うときは状態方程式を使った方が計算がしやすくなります。こちらもあわせて知っておきましょう。
なお比例定数はまだ計算せずにとっておくようにしましょう。
②窒素の比例定数を求める
次に窒素の比例定数を求めます。
酸素のときと同様に標準状態で23mL溶けるので、まず標準状態で溶ける窒素の物質量を求め、それを圧力と水の体積で割って比例定数つまり1Pa、水1Lあたりに溶ける窒素との物質量を求めます。
これで酸素と窒素の比例定数を求めることができたので、あとは計算公式を使って小問を解いていきます。
それでは小問を解いていきます。先ほども言いましたが、比例定数は基本的に計算しないでおきましょう。
小問①:水に溶けた酸素の体積
それでは1問目です。標準状態で混合気体と水1Lが接しているとき、溶けている酸素は何mLか求めてみましょう。
方程式を立てる
まず求める体積をV[mL]とします。そして、ヘンリーの法則の計算公式にそれぞれ代入すると以下のようになります。
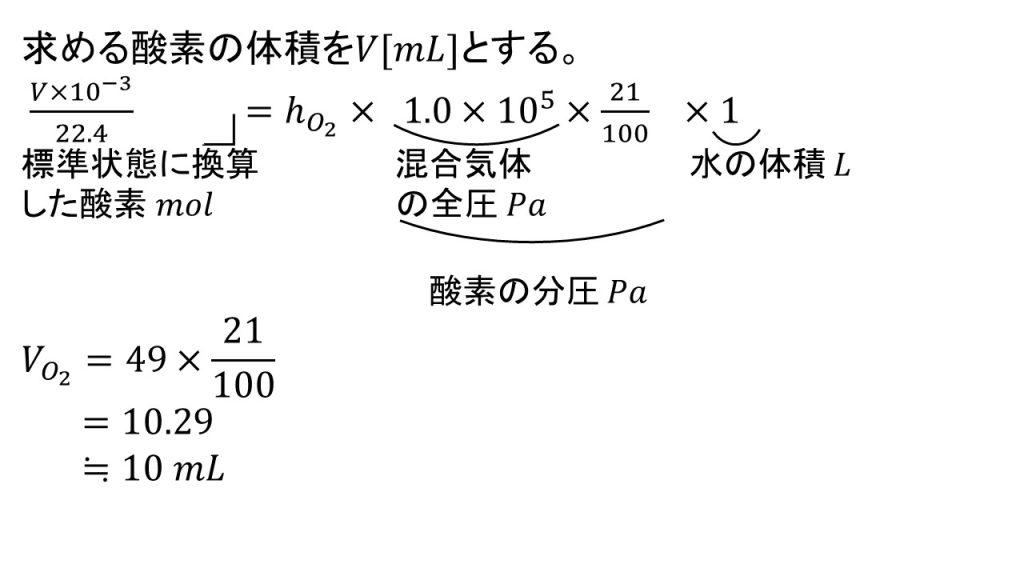
V[mL]を10-3倍することでLとなり、それを22.4L/molで割ることで、溶けている酸素の物質量となります。
そして右辺ですが、まずは比例定数です。つまり1Pa、水1Lにおける酸素の物質量です。それに1.0×105×21/100Paをかけます。
この21/100を忘れないようにしましょう。なぜ21/100なのかというと、今回水1Lに接しているのは混合気体なので、酸素の分圧としないといけないからです。つまり全圧が1.0×105Paの混合気体のうち、酸素は21%を占めているので酸素の分圧は1.0×105×21/100Paとなるのです。混合気体の場合は、ヘンリーの法則の圧力の部分は分圧で考えるということはよく間違えやすいので注意してください。
そして今回水は1Lなので1Lをかけます。
方程式を解く
これで方程式ができたので、あとは方程式を解いていきます。ここで比例定数を計算しなかったことが活きていきます。
約分ができたり両辺に同じものがあるので、それらを整理するとV=49×21/100となり、これを計算すると10.29となり、有効数字2桁になるように四捨五入をして答えが10mLとなります。
このようにヘンリーの法則の公式を使うと方程式を作ることができるようになり、確実に問題が解けるようになります。
小問②:水に溶けた窒素の質量
それでは同様に残りの小問も解いていきます。
2問目は標準状態で混合気体と水1Lが接しているとき、溶けている窒素のmgを求めてみましょう。
方程式を立てる
まずは求める質量をw[g]とします。そしてヘンリーの法則の計算公式を使って方程式を立てます。
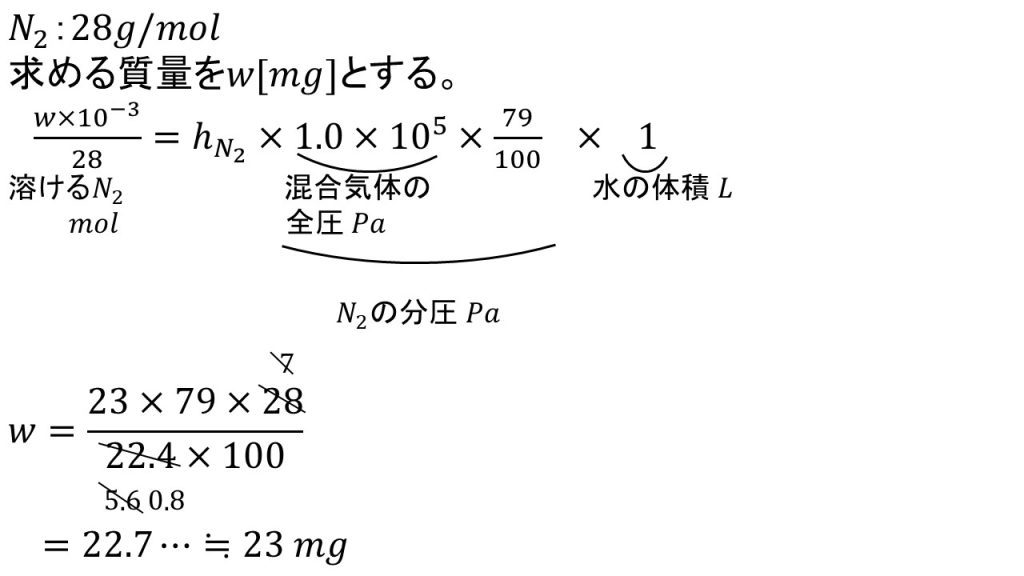
まずは求める質量のmgを10-3倍することでgとし、それをモル質量で割ることで溶けている窒素の物質量とします。
そして比例定数つまり1Pa, 水1Lに溶ける窒素との物質量を書き、それに窒素の分圧をかけます。窒素の分圧は混合気体の全圧に79/100倍したものとなります。
最後に水の体積をかけて方程式の完成です。
方程式を解く
あとは約分などをして式を整理し、求めたい文字だけを左辺に持ってきて残りを右辺に集めます。
そして約分できるだけ約分をして、掛け算と割り算をして有効数字が2桁なるように四捨五入をすると答えは23mgとなります。
小問3:水に溶けた酸素の分子数
3問目も同様に解きます。
標準状態で混合気体と水1mLが接しているとき、溶けている酸素分子の個数を求めてみましょう。
方程式を立てる
まずは求める個数をN個として、ヘンリーの法則の計算公式を使って方程式を立てます。

酸素分子の個数をアボガドロ定数で割ることで溶けている酸素の物質量とします。
そして、酸素の比例定数に酸素の分圧をかけ、今回は水1mLなので1×10-3Lが水の体積となります。
方程式を解く
あとはこの方程式を解いていきます。
約分などをしながら求めたい文字だけを左辺におき、残りを右辺に集めます。
そして、できるだけ約分をしていきます。この場合は、まず10から処理していきましょう。10倍を使って小数点を動かし、さらに10で約分して、10-3を2つを整理します。
あとは約分をして残ったもので掛け算と割り算をして有効数字2桁になるように四捨五入をしたら、答えは2.8×10-17個となります。
いかがだったでしょうか。今回ご紹介したやり方は教科書や参考書には載っていないやり方ですが、ヘンリーの法則の原理に則ったやり方なので確実に問題を解くことができるようになります。是非試してみてください。
(3)解説授業の内容を復習しよう
(4)ヘンリーの法則の解説一覧
①教科書には書かれていないヘンリーの法則の計算公式(そもそもヘンリーの法則とは何かについても解説しています)
②なぜ圧力を変えても水に溶ける気体の体積は変わらないのか(ヘンリーの法則をより深く理解しましょう)
(5)参考
☆化学の解説動画・授業動画一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識テスト一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学の解説・授業・知識・演習問題一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学の語呂合わせ(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
「化学計算の王道」シリーズは『思考訓練の場としての体系化学』(GHS予備校)を参考にしています。
GHS予備校についてはこちら→https://ghs-yobikou.co.jp/
思考訓練シリーズの購入はこちら→https://ghs-yobikou.shop/
