☆問題のみはこちら→凝固点降下・沸点上昇の計算(問題)
☆解説授業①:凝固点降下・沸点上昇(なぜ質量モル濃度の分母が溶媒なのか、計算における注意点についても解説しています)
☆解説授業②:モル濃度から質量モル濃度への変換
☆解説授業③:凝固点降下の計算を極める問題
※原子量:H=1, C=12, O=16, Na=23, Cl=35.5, Ca=40, Br=80
※分子量は整数で答えよ。それ以外の問題は有効数字2桁で答えよ。
①水100gにショ糖2.28gを溶かした溶液の凝固点を測定したところ、−0.124℃であった。水のモル凝固点降下を1.86として、ショ糖の分子量を求めよ。

②ある不揮発性の有機化合物1.6gを50gのベンゼンに溶かした溶液の凝固点は4.25℃であった。純ベンゼンの凝固点は5.50℃、モル凝固点降下は5.00である。この有機物の分子量を求めよ。

③水のモル凝固点降下を1.86として答えよ。水とエタノールを混合して、−10℃でも凝固しない溶液を作るには、水1kgに少なくとも何gのエタノールを混合すればよいか。
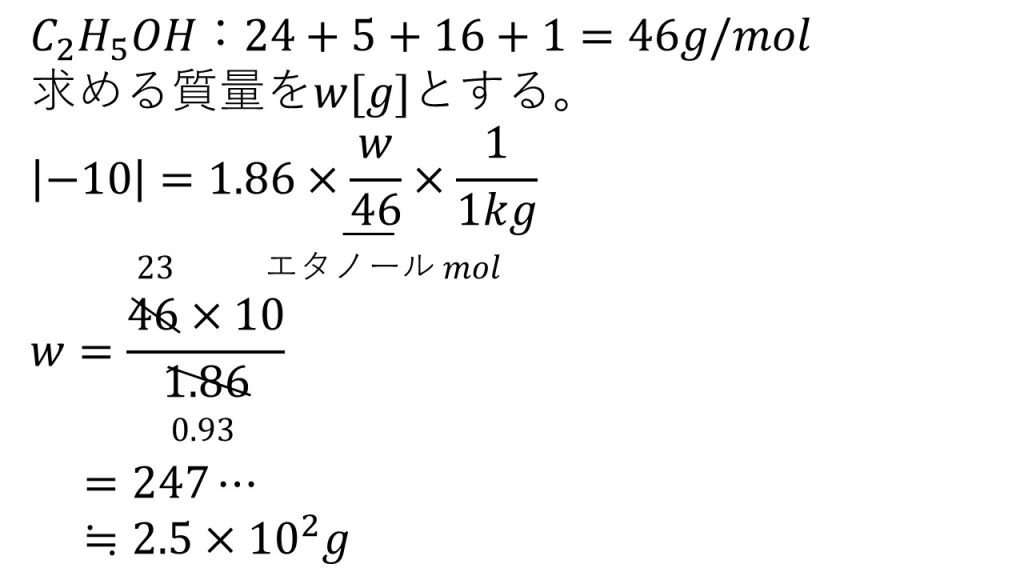
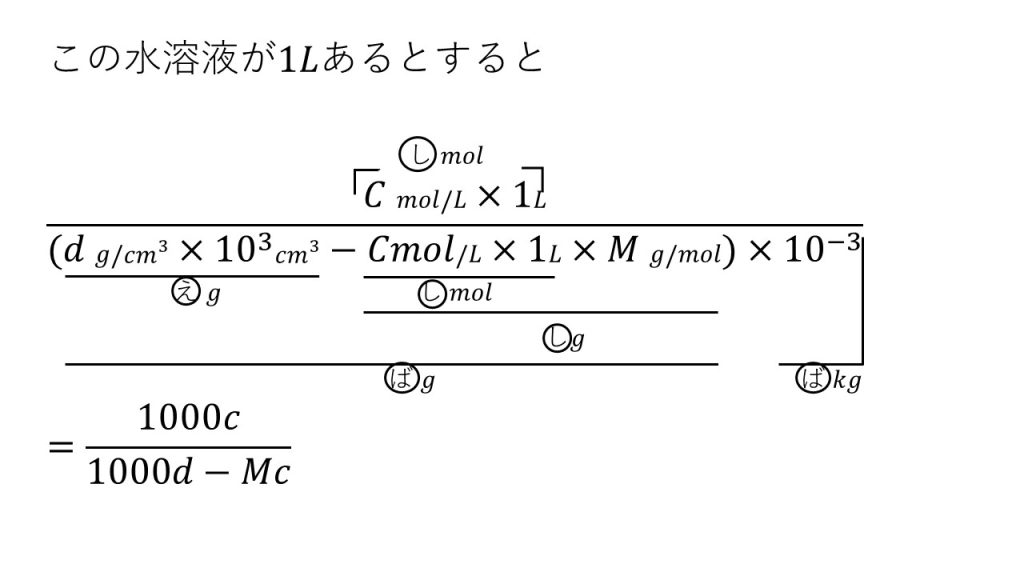
④ある物質(分子量M)の水溶液があり、モル濃度はC[mol/L]で、密度はd[g/㎤]である。この水溶液の濃度を質量モル濃度で表すと何mol/kgか。
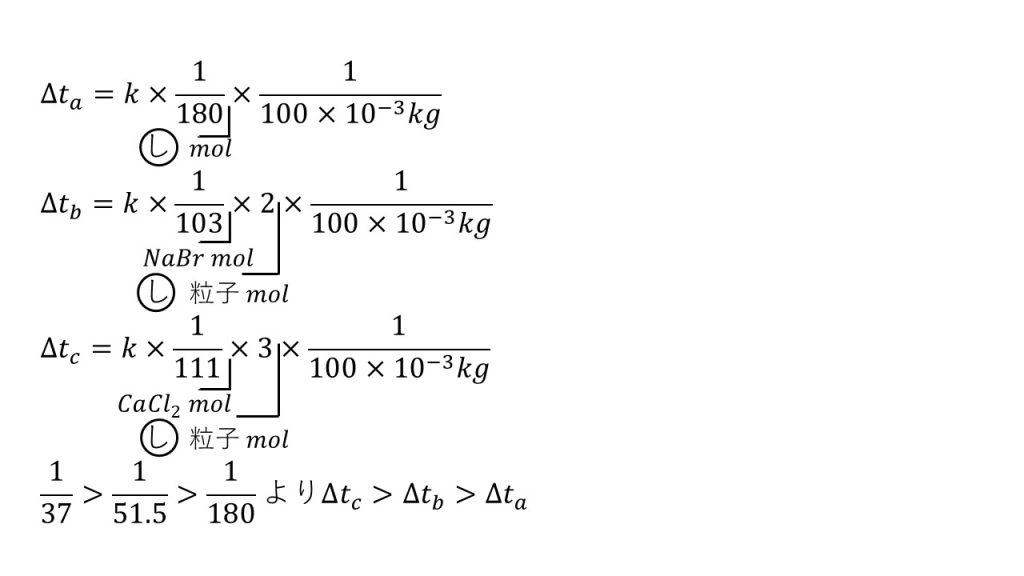
⑤以下の3種類の水溶液a,b,cを沸点の高いものから順に並べなさい。ただし、溶質が電解質である場合は、水溶液中で完全に電離しているものとする。
a:水100gにブドウ糖1gを溶かした溶液。
b:水100gに臭化ナトリウム1gを溶かした溶液。
c:水100gに塩化カルシウム1gを溶かした溶液。

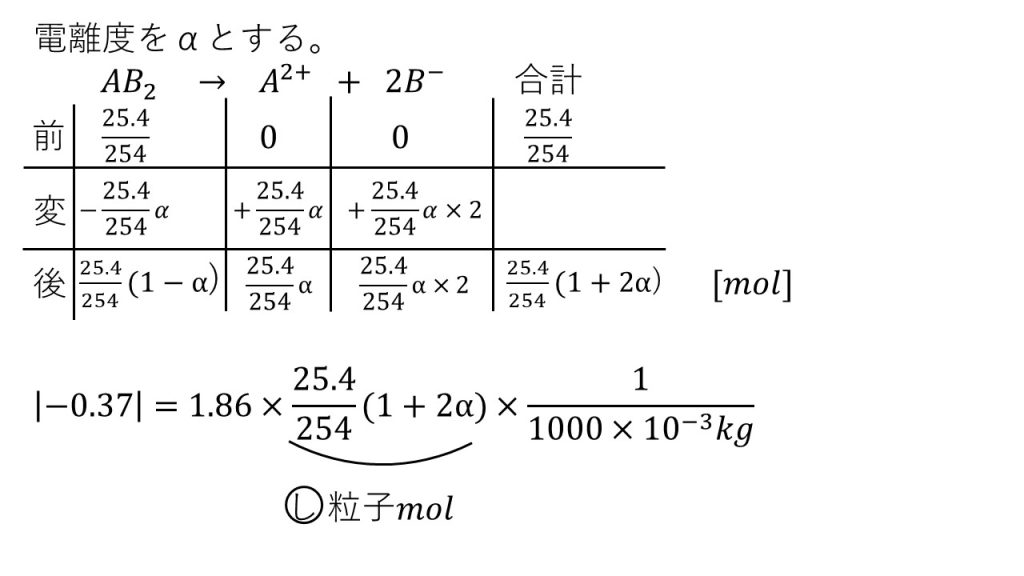
⑥A2+イオンとB–イオンとからなる電解質AB2(式量254)25.4gを水1000gに溶かした水溶液が−0.37℃の凝固点を示した。AB2の電離度はいくらか。ただし、水のモル凝固点降下は1.86とする。
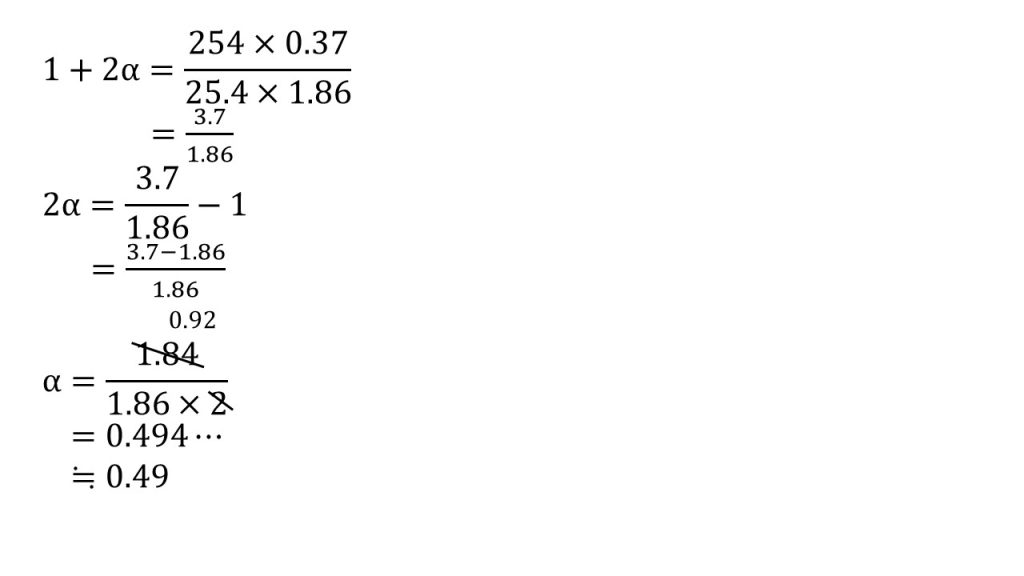
☆問題のみはこちら→凝固点降下・沸点上昇の計算(問題)
【解説授業】
①凝固点降下・沸点上昇(なぜ質量モル濃度の分母が溶媒なのか、計算における注意点についても解説しています)
「化学計算の王道」シリーズは『思考訓練の場としての体系化学』(GHS予備校)を参考にしています。
GHS予備校についてはこちら→https://ghs-yobikou.co.jp/
思考訓練シリーズの購入はこちら→https://ghs-yobikou.shop/
~参考~
☆化学計算の王道(化学基礎・理論化学) ←その他の単元の計算問題と解説はこちら
☆化学の解説動画・授業動画一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識テスト一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学の解説・授業・知識・演習問題一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
