(1)解説授業動画
☆YouTubeチャンネルの登録をよろしくお願いします→大学受験の王道チャンネル
(2)解説授業の原稿
今回は凝固点降下の計算を極めるための問題の解説を行います。
なお、凝固点降下の基本的な考え方や式の立て方などは理解している前提で話を進めます。もしそういったところの理解が不十分な場合は、まずは凝固点降下の基本的な解説を確認してください。
問題:溶質の電離度が1ではないとき
それでは問題を確認します。
A2+とB-からなる電解質AB2(式量254)を15.4g、水1000gに溶かします。そうすると、その溶液の凝固点は-0.37℃となりました。ではAB2の電離度αはいくつになるでしょうか。ただし水のモル凝固点降下は1.86とします。
電解質の確認
凝固点降下や沸点上昇の問題は、まず溶質が電解質かどうかを確認します。これによって計算で使う溶質の物質量が変わってくるので、必ず電解質か非電解質かを確認します。
今回は電解質でAB2はA2+と2B-に電離します。ただし、今回は電離度が1ではないので単純に3倍をすればよいというわけにはいきません。
では、このように電離度が1ではないとき、どのようにすればよいのでしょうか。
反応前・変化量・反応後の表
今回の電離のように、完全に反応が進行せず未反応のものが残るような反応の場合は、反応前、変化量、反応後のそれぞれの物質量を表にまとめるのが基本的な方針となります。
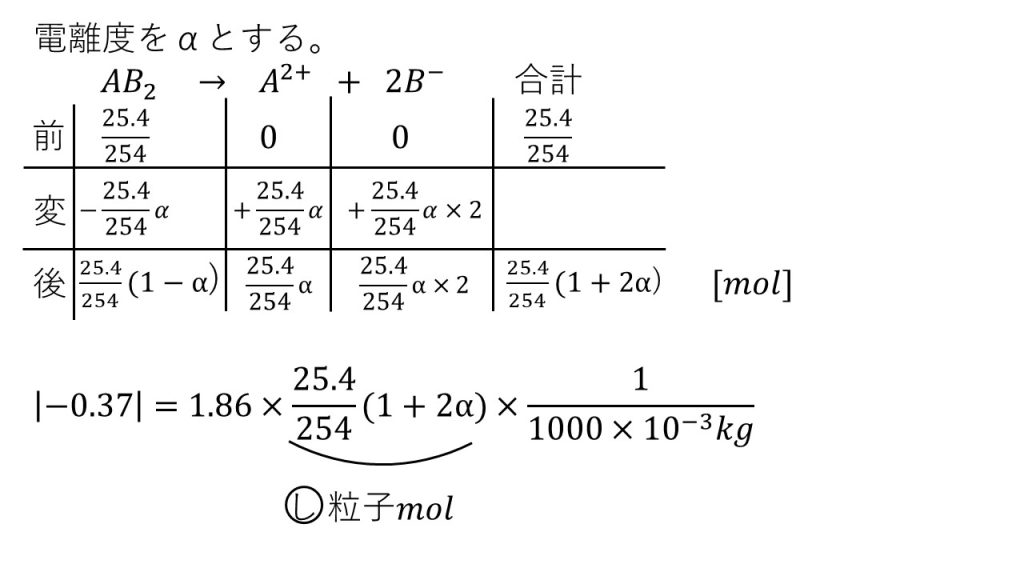
まず電離する前のAB2は25.4/254molとなり、まだ電離をしていないので A2+とB-は0molです。
次に変化量ですが、電離をすることによって、AB2は25.4α/254mol減少することになります。電離度の分だけで電離したということは、電離度の分だけAB2が減少したということなのでこのようになります。
そして、この反応式の係数の比を見てみると、1:1:2となっているので、AB2が減った分だけA2+は増えて、B-はAB2が減った量の2倍に増えることになります。
電離後のそれぞれの物質量は、反応前と変化量を足すことで求めることができます。
そして、この表はここで終わるのではなく、反応後の合計の物質量を出しておきましょう。この反応後の合計の物質量は、後で使用します。
方程式を立てる
それでは凝固点降下の式を使って方程式を立てていきましょう。左辺は凝固点降下度なので、絶対値をつけて正にすることを忘れないようにしましょう。
そして右辺は、比例定数であるモル凝固点降下の1.86に、溶液に溶けている粒子すべての物質量をかけ、今回は1000gなので1㎏で割ります。
溶質の物質量に注意する
ポイントは物質量の部分が、電離後のそれぞれの物質量を合計したものであるということです。なぜなら、凝固点降下の式のnの部分は粒子であったら何でもいいので、電離せずに残った分子であろうと、電離した後のイオンであろうと、すべて凝固点降下を起こす粒子となるので、それぞれの物質量を合計したものを使わないといけないのです。
このように凝固点降下や沸点上昇あるいは浸透圧といった希薄溶液を考えるときは、種類に関係なく粒子すべてを考えるといったことが重要なポイントとなります。
工夫しながら方程式を解く
それでは計算をしていきます。
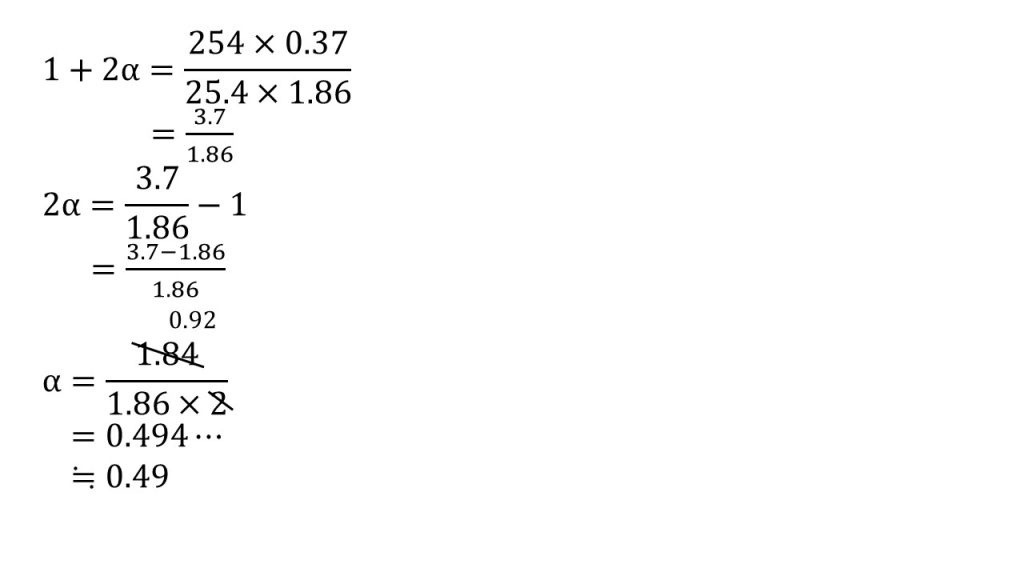
まずは簡単に約分できるところは約分しておきます。そして、文字を含む項を左辺に、それ以外を右辺に集めます。そして左辺を文字だけにしたいので、1は右辺に移項します。
分数のたし算やひき算は通分をして、計算し、そして両辺を1/2倍して、割り算をして、有効数字二桁になるように四捨五入をしたら答えが0.49となります。
いかがだったでしょうか。この問題が自力でできるようになれば、凝固点降下や沸点上昇など希薄溶液を理解しているといえます。ぜひ復習しておいてください。
(3)解説授業の内容を復習しよう
(4)希薄溶液(凝固点降下、沸点上昇、浸透圧)の解説
①凝固点降下・沸点上昇(なぜ質量モル濃度の分母が溶媒なのか、計算における注意点についても解説しています)
④浸透圧の解説(なぜ浸透圧の式と理想気体の状態方程式が同じ式になるのかについても解説しています)
☆おまけ:希薄溶液と気体の類似性(ファント・ホッフ「第1回ノーベル化学賞受賞記念講演」より抜粋)
(5)参考
☆化学の解説動画・授業動画一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識テスト一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学の解説・授業・知識・演習問題一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学の語呂合わせ(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
「化学計算の王道」シリーズは『思考訓練の場としての体系化学』(GHS予備校)を参考にしています。
GHS予備校についてはこちら→https://ghs-yobikou.co.jp/
思考訓練シリーズの購入はこちら→https://ghs-yobikou.shop/
