(1)解説授業動画
☆YouTubeチャンネルの登録をよろしくお願いします→大学受験の王道チャンネル
(2)解説授業の原稿
今回はモル濃度から質量モル濃度への変換の問題の解説をします。
この濃度変換の問題はよく出題されるのですが、苦手とする人が多いようです。今回の解説でしっかりとマスターするようにしましょう。
まずは問題を確認します。
分子量Mの非電解質を溶かした水溶液があり、モル濃度はC[mol/L] で密度は d[g/㎤]である。この水溶液の質量モル濃度を表してみましょう。
このような濃度変換の問題は、とにかく単位に注意すること、そして分母と分子の式を1つずつずつ丁寧に作っていくということ、この2つが重要です。
それでは問題を解いていきましょう。
まずは求める質量モル濃度の単位を確認します。質量モル濃度の単位はmol/kgです。ただし注意しないといけないのは、分子は溶質のmolであり分母は溶媒のkgであるということです。
それでは答案を作っていきます。
問題文に体積の情報がないので自分で1Lと設定します。溶液の濃度は体積によって変わることがないので、1Lなど計算しやすい値に体積を設定して構いません。
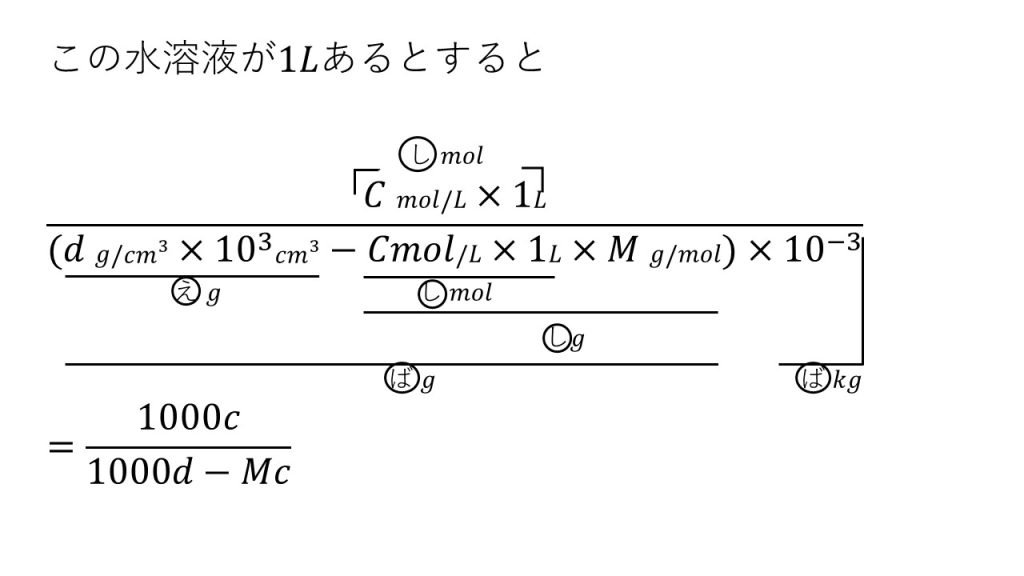
これが質量モル濃度を表す式です。複雑に見えますが丁寧に単位を追っていきましょう。
まずはわかりやすい分子から見ていきます。溶液のモル濃度に、溶液の体積をかけることで溶質の物質量となります。
そして分母です。
溶液の密度に溶液の体積をかけることで溶液の質量(g)となります。ちなみに1Lは1000㎤ となります。そして分母は溶媒にしないといけないので、溶液の質量から溶質の質量を引きます。まずは分子と同様に、溶液のモル濃度に溶液の体積をかけることで溶質の物質量となります。そして、これをグラムに変換するために溶質のモル質量をかけます。こうすることで溶質もグラムとなり、溶液のグラムから溶質のグラムを引くことで溶媒のグラムになります。そして、分母は溶媒のキログラムなので、最後に10-3をかけることで溶媒のキログラムとなり式が完成します。
そして、これを計算すると、答えは1000C/(1000d-MC)となります。
いかがだったでしょうか。濃度の変換をするときは、とにかく単位に注意して、そこまでで溶質溶媒溶液の何が出ているのかを確認しながら式を作るようにすれば確実に解けるようになります。
(3)解説授業の内容を復習しよう
(4)希薄溶液(凝固点降下、沸点上昇、浸透圧)の解説一覧
①凝固点降下・沸点上昇(なぜ質量モル濃度の分母が溶媒なのか、計算における注意点についても解説しています)
④浸透圧の解説(なぜ浸透圧の式と理想気体の状態方程式が同じ式になるのかについても解説しています)
☆おまけ:希薄溶液と気体の類似性(ファント・ホッフ「第1回ノーベル化学賞受賞記念講演」より抜粋)
(5)濃度計算の解説一覧
①濃度計算の基本(質量パーセント濃度とモル濃度、濃度変換についても解説しています)
(6)参考
☆化学の解説動画・授業動画一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識テスト一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学の解説・授業・知識・演習問題一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学の語呂合わせ(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
「化学計算の王道」シリーズは『思考訓練の場としての体系化学』(GHS予備校)を参考にしています。
GHS予備校についてはこちら→https://ghs-yobikou.co.jp/
思考訓練シリーズの購入はこちら→https://ghs-yobikou.shop/
