(1)解説授業動画
☆YouTubeチャンネルの登録をよろしくお願いします→大学受験の王道チャンネル
(2)解説授業の原稿
今回は物質量つまりモルをつかった計算を解説します。物質量をつかった計算は化学の計算においては基本中の基本です。必ず今回の解説で理解するようにしましょう。
具体的な問題をつかって解説をするのですが、その前にいくつかポイントを確認しておきます。
物質量とは何か
まずはそもそも物質量とは何かについて確認します。
物質量とは、原子や分子やイオンなどといった粒子を6.0×1023個集めたものを1molと定義したものです。
つまりモルとはあくまで個数の単位であるということに注意してください。例えば12個のものをまとめて1ダースと呼ぶように、小さな粒を6.0×1023個集めたものを1モルと呼んでいるのです。
このように物質量とは粒の個数を表しているので、質量(g)とは全く別物であるということに注意してください。
物質量を使った計算の2つの方針
続いて物質量をつかった計算の2つ方針を解説します。
方針①:単位で計算する
まず1つ目の方針は、「単位で計算する」ということです。
単位で計算するという方針は化学の計算だけでなく、物理など他の理科の計算でもつかえる方針です。つまり、単位を見れば何と何をかければよいのか、何と何を割ればいいのかが分かる、ということです。
例えば、モル質量の単位はg/molなので、モル質量に、物質量つまりモルをかけることで、グラムつまり質量が求められるということがわかります。
あるいは、質量gをモル質量g/molで割ると、g/molの逆数がmol/gとなるので、答えがモルつまり物質量となる、ということもわかります。
このように単位に着目することでどのように計算すればよいかがわかるようになります。
物質量(mol)がからむ3つの単位
ちなみに化学基礎で物質量(mol)がからむ単位は3つあります。
ⅰ)1つ目がモル質量です。モル質量とは、その原子や分子などが1molつまり6.0×1023個集まったら何gになるかを表しています。例えば炭素であれは12g/mol、H20であれば18g/molとなります。
基本的には、原子量や分子量などにg/molの単位をつけたものがモル質量となります。ただし、今回詳しく解説はしないのですが、原子量や分子量とは別物なので区別するようにしましょう。ちなみに、原子量や分子量には単位はありません。また、化学式に=をつけることができるのは原子量や分子量の方で、モル質量には=を使わないようにしましょう。
ⅱ)また、化学基礎で出てくる単位としてアボガドロ定数があります。アボガドロ定数は1molが6.0×1023であることを表しています。
ⅲ)さらに化学基礎の計算で使う単位として、標準における気体の体積があります。標準状態つまり0℃1大気圧において、気体の分子を1molつまり6.0×1023個集めたら、体積は22.4Lになります。
これは気体の種類に関係なくそうなります。つまり標準状態において酸素分子を6.0×1023個集めたら22.4Lとなり、水素分子を標準状態で6.0×1023個集めても、その体積は22.4Lとなります。さらに標準状態において酸素分子と水素分子を混ぜたものを合計6.0×1023個集めてもその体積は22.4Lとなります。
方針②:物質量(mol)で方程式を立てる
それでは最後に物質量をつかった計算の2つ目の方針を確認します。
2つ目の方針は、「物質量(mol)で方程式を立てる」ということです。
これは、「たとえ温度や圧力などの状態が変わったとしても、物質を構成している原子や分子の数は変化しない」という原則からきています。これは化学に取り組む上で最も重要な原則の1つです。この前提があるから方程式を立てたり、計算したりすることができるのです。
「化学の計算において困ったらとりあえずモルを求めてみる」
というのは大切な考え方です。
問題①:物質量から質量を求める
それでは具体的に問題をときながら物質量を使った計算をマスターしていきましょう。
次の3つの問題は「単位で計算する」という方針で解いてみます。
1つ目の問題は、「メタンは0.20molあるとき、それは何gか」というものです。
グラムとモルがあるので、まずはメタンのモル質量を求めます。
メタンはCH4なので、12+1×4をして、16g/molとなります。
あとはグラムを求める問題なのでg/molにmolをかけます。すると答えは3.2gとなります。
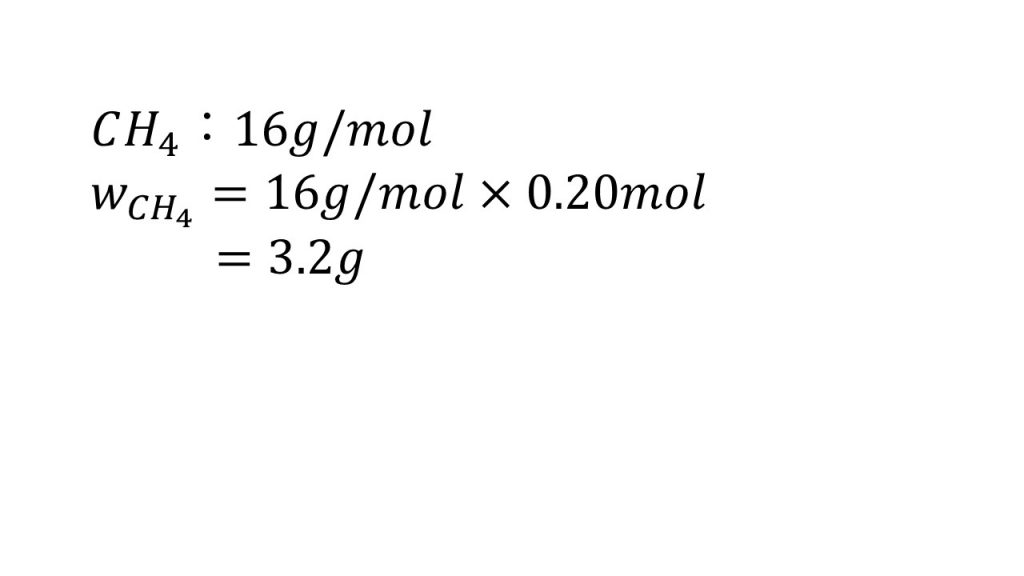
このように化学の計算をするときは、単位を書きながら計算するようにすると、間違えることなく計算できるようになります。
問題②:分子の個数から質量を求める
続いて2番目の問題は、「水分子を2.5×1023個集めたとき、何gとなるか」という問題です。
今回もグラムを問われているので、水のモル質量を求めておきます。そして単位を見て式を考えます。
式を立てる
個からグラムに直接変換する単位はないので、とりあえずモルを求めてみます。
個をモルにするためにアボガドロ定数で割ります。個÷個/molでモルを求めることができます。式を書くときは、なるべく割り算の記号は使わずに分数の形で書くようにしましょう。その方が、計算が楽になることが多いです。
そして水分子のモルが出たので、次にグラムを求めるために、モル質量をかけます。するとmol×g/molで答えがグラムになります。
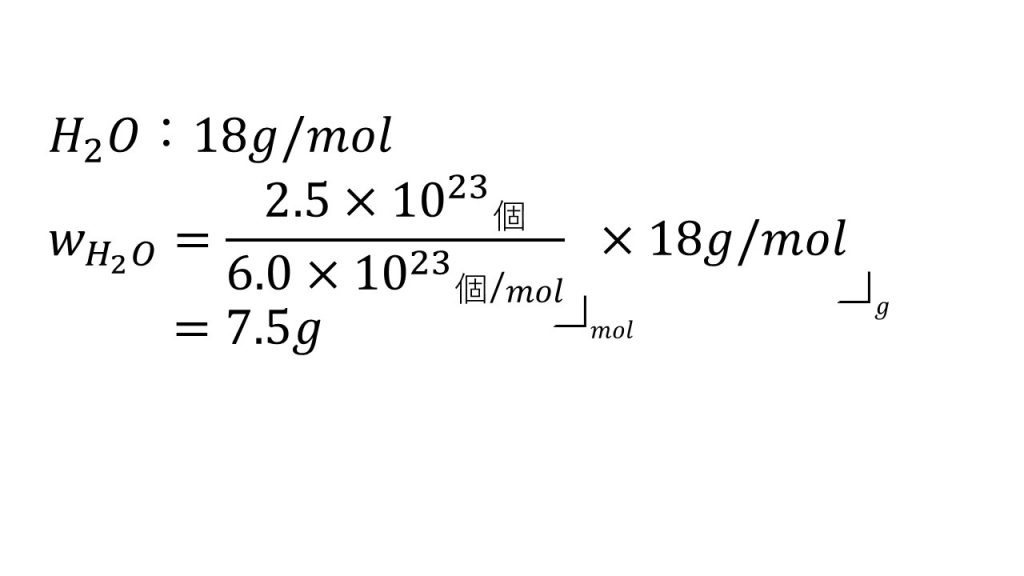
化学の計算のポイント
ここで計算のポイントですが、水の物質量を求める段階で割り算をしてしまうのではなく、最後まで式を書いて、約分できるだけ約分してから、かけ算や割り算をするようにしましょう。
例えばこの式でいえば、まず、1023を約分して、分母の6とこちらの18を約分します。すると答えを暗算で7.5gとすることができます。
このように、「先に約分をして残りを計算する」というのが計算の鉄則となります。
また、『ここまでで何が出ているのか』といった単位のメモを書くことも正確に計算するためには重要です。
今後化学の計算をするときは、僕の式の書き方や計算の仕方、あるいはメモの書き方などを真似するようにしてください。
問題③:質量から気体の体積を求める
それでは3番目の問題です。「二酸化炭素1.1gは標準状態で何ℓとなるか」という問題です。
こちらもグラムの単位があるのでモル質量を求めておきます。CO2のモル質量は44g/molとなります。
グラムをリットルに直接変換できないので、今回もとりあえずモルを求めてみます。質量を物質量にするには、質量÷モル質量をします。つまりg÷g/molをすることでモルとなります。
次にモルをリットルにするために、22.4L/molをかけます。mol×L/molはリットルとなります。
あとは計算ですが先ほどの同様に、まず約分できるだけ約分をします。11で約分をし、4で約分をします。そして残った0.1と5.6をかけて、答えは0.56Lとなります。
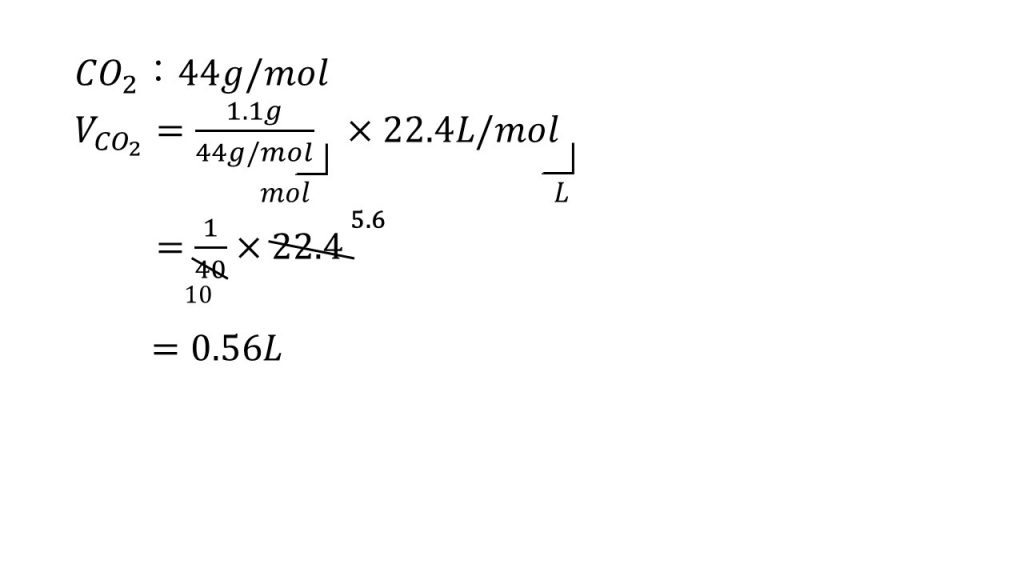
このように単位に着目することで式を立てられるようになり、計算の工夫をしていくことで正確に速く計算することができるようになります。
方程式を立てて解いてみる
またこれらは1つ目の方針である単位で計算するというやり方で解きましたが、2つ目の方針である物質量で方程式を立てるというやり方でも計算できます。
問題①
1番の問題では、メタンの質量を求めるので求めるものをWメとおき、
0.20mol = Wメ/16[g/mol]
という方程式が立てられます。こうすれば両辺がモルとなり、イコールで結ぶことができます。
問題②
2番目の問題は、水の質量を求める問題なので求めるものをW水とします。そして左辺は、6.0×1023個/mol分の2.5×1023個とし、右辺は18g/mol分のW水gとします。
2.5×1023個/6.0×1023[個/mol]=W水g/18[g/mol]
こうすることで両辺がモルとなり方程式をつくることができます。
問題③
3番目の問題では、求めるものが体積なのでVとおき、左辺を44g/mol分の1.1gとし、右辺を22.4L/mol分のVLとします。
1.1g/44[g/mol]=VL/22.4L/mol
こうすれば両辺がモルとなるので方程式を立てることができます。
基本的には物質量をつかった計算は、1つ目の方針と2つ目の方針のどちらでも解くことができます。もちろんどちらのやり方で解いての答えは同じものになるので、楽に解ける方あるいは式を立てやすい方で解くようにしましょう。
問題④:原子量を求める問題
それでは次に以下の2つ問題を解いてみます。この2つの問題は2つ目の方針つまり「物質量で方程式を立てる」という方針の方が解きやすい問題です。
それでは実際にやってみます。ただし今回これらの問題は有効数字2桁で答えます。
まずは1つ目の問題は、ナトリウム1個3.82×10-23gとしたとき、ナトリウムの原子量を求める問題です。
方程式を立てる前に、まず求めるものを文字で置きます。今回は原子量を求めるのでMと起きます。するとモル質量がMg/molとなります。
物質量で方程式を立てる
あとは問題文の条件と、置いた文字をつかって方程式を立てます。
両辺の単位をモルにしないといけないので、モルに変換できる情報が2つ必要であるということになります。
今回、問題文を一見するとモルに変換できそうな情報が、3.82×10-23gしかないようにみえますが、「1個」という情報を見落とさないようにしてください。個数はアボガドロ定数をつかえばモルに変換できる情報です。
これで、問題文からモルにできる情報を2つ読み取ることができたので、この2つの情報を使って物質量についての方程式を立てます。
まず左辺は「1個」をアボガドロ定数で割ったものにします。個÷個/molとすればモルにすることができます。
右辺はグラムをモルに変換するためにg÷g/molをします。これで右辺もモルとなり、両辺がモルの方程式を立てることができます。
工夫しながら計算する
そしてあとはこの方程式を解いてMの値を求めようと思います。
方程式の計算の手順は、まず左辺が求めたい文字だけになるように式変形します。今回でいえば両辺にMをかけた後両辺に6.0×1023をかけます。
あとは計算をして、有効数字2桁になるように四捨五入したら答えとなります。

問題⑤:鉄原子1個の体積を求める
次の問題は「鉄の密度を7.8g/cm3とすると、鉄原子1個の体積は何cm3か」という問題です。
こちらも、まず求めるものを文字でおきます。今回は体積を求めるのでVとおきます。
物質量で方程式を立てる
そして先ほどと同様にこの2つの情報から物質量について方程式を立てます。
まずは密度ですが、「密度」と聞いただけで拒絶反応を示してしまう人がいますが、単位を見る癖をつけておけば密度は何も怖くありません。
密度の単位はg/cm3なので、結局のところ、密度は質量と体積を変換するためのものにすぎない、ということになります。密度に体積をかけると質量になり、質量から密度を割ると体積になります。
そのため左辺は、密度に体積をかけることでグラムなり、グラムをモル質量で割ることでモルとなります。
そして、右辺は「1個」という情報をモルに変更するために、1個÷アボガドロ定数をしてモルとします。
これで両辺が物質量の方程式を立てることができました。
工夫しながら計算する
あとは計算ですが、まずは求めたい文字だけを左辺に残し、残りを右辺に全部もっていきます。
そして約分できるだけ約分していきます。約分をしたあとは、まず掛け算から先にします。
そして割り算は最後の1回だけにするというのが理科の計算の鉄則です。なぜなら今回のように、割り切れない割り算を先にしてしまうと、計算がしにくくなったり、正確な値が出なくなったりするので、割り算は最後の1回までとっておくようにしましょう。
あとは有効数字が2桁になるように四捨五入をして答えとなります。

いかがだったしょうか。「物質量で方程式を立てる」という方針は、基本的にどのような問題にも対応できます。そのため、とりあえずモルを出してみて方程式をつくれないか考えてみましょう。
また、単位に着目して式を立てるということや、理科の計算を効率よく行うための工夫といったものも身につけるようにしましょう。
以上で物質量をつかった計算の解説をおわります。
(3)解説授業の内容を復習しよう
(4)物質量(mol)を使った計算
①物質量(mol)を使った計算(理科の計算の原則と、計算の工夫の仕方についても解説しています)
③気体の分子量を求める問題の解説(比重とは何かについても解説しています)
(5)参考
☆化学の解説動画・授業動画一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識テスト一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学の解説・授業・知識・演習問題一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学の語呂合わせ(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
「化学計算の王道」シリーズは『思考訓練の場としての体系化学』(GHS予備校)を参考にしています。
GHS予備校についてはこちら→https://ghs-yobikou.co.jp/
思考訓練シリーズの購入はこちら→https://ghs-yobikou.shop/
