(1)解説授業動画
☆YouTubeチャンネルの登録をよろしくお願いします→大学受験の王道チャンネル
(2)解説授業の原稿
今回は凝固点降下と沸点上昇について解説します。
凝固点降下・沸点上昇とは何か
まずそもそも凝固点降下とは何か、あるいは沸点上昇とは何かについて確認します。
凝固点降下とは溶液、つまり溶媒に溶質を加えたものは、ただの溶媒よりも凝固点が下がる現象のことです。そして、沸点上昇とは溶液はただの溶媒よりも沸点が上がる現象のことです。
なぜこのような現象が起こるのか簡単に説明します。
物質は固体・液体・気体の3つの状態があります。
液体の状態はそれぞれの分子や原子が分子間力でゆるくつながっている状態です。
その分子や原子が綺麗に整列して固まった状態を固体といい、液体から固体になることを凝固といいます。
また、それぞれの粒子がお互いの分子間力を振り切り、ばらばらに動けるようになった状態のことを気体といい、液体から気体に状態変化をすることを蒸発といいます。
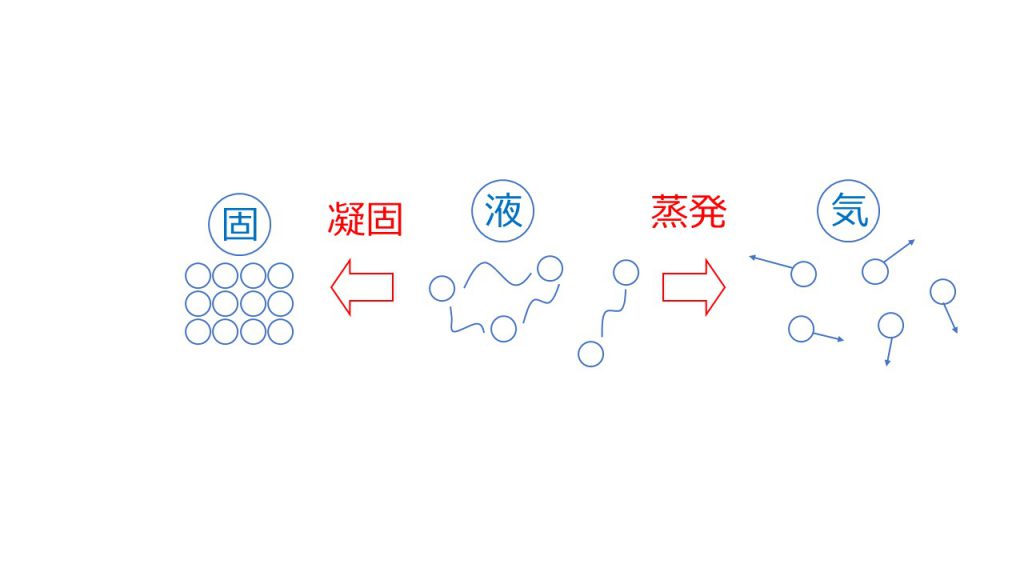
例えば水であれば、凝固点は0℃で沸点は100℃となります。しかし塩などの溶質を加えると、液体が固体になったり、液体が気体になったりするのを邪魔してしまうので、溶媒だけのときよりも凝固とするのに時間がかかってしまい、凝固点が下がってしまいます。
また溶質が邪魔をするので、溶媒だけのときよりも蒸発するのに余計なエネルギーが必要となり沸点が上昇するのです。
つまり、水に塩などの溶質を加えると凝固点が0℃よりも下がり、沸点は100℃よりも高くなります。
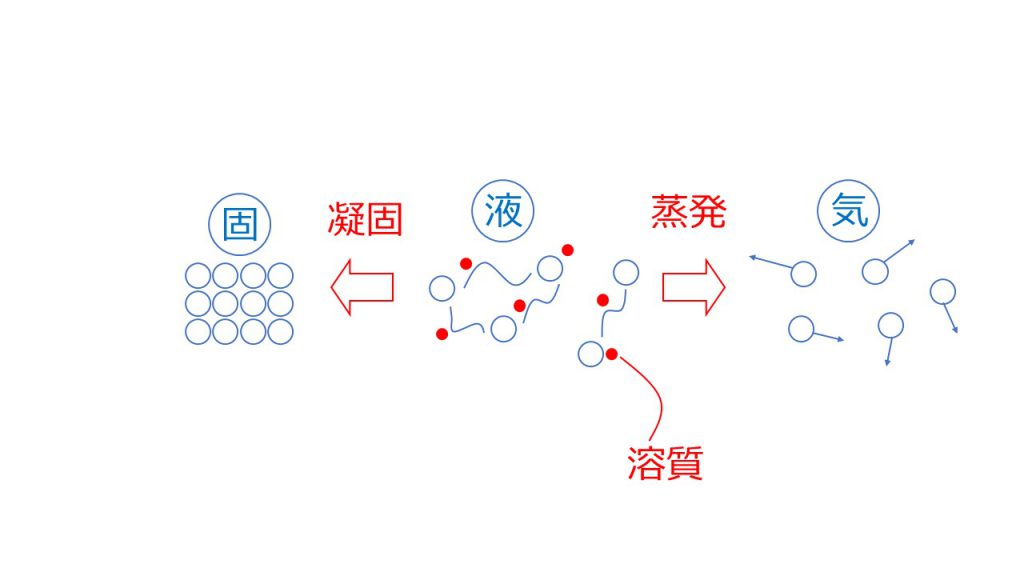
これが凝固点降下と沸点上昇という現象です。
凝固点降下・沸点上昇の計算公式
教科書の計算公式
続いて計算の公式を確認します。教科書や参考書には、以下のように
Δt =k・m
と書いてあります。
Δtは凝固点降下度あるいは沸点上昇度と呼ばれ、単位はKです。これは元の溶媒の凝固点から何K凝固点が下がったか、あるいは元の溶媒の沸点から何K沸点が上昇したかといった温度変化を表しています。
そして、kはモル凝固点降下あるいはモル沸点上昇と呼ばれる比例定数を表しています。
さらにmは質量モル濃度を表しています。単位はmol/kgなのですが、molは溶質の物質量で、kgは溶媒の質量であることに注意してください。
要するにこの式が意味していることは、どれくらい凝固点降下あるいは沸点上昇が起きるかは質量モル濃度に比例する、ということです。
もちろんこの計算公式で問題を解くことができます。しかし実際の問題で、質量モル濃度がそのまま与えられていることはあまりありません。
実際に使える計算公式
そのため計算問題を解くときは、以下の式を使うことをおすすめします。
Δt =k・n・1/W
nは溶質の物質量で、Wは溶媒の質量となります。つまり、質量モル濃度をバラバラにしただけなのですが、実際の問題では、溶媒の質量は問題文に書いてありますが、溶質の物質量は自分で求めることが多いので、このような計算公式だと考えたほうが計算がやりやすくなります。
ちなみに2つ目の式は、凝固点が何K下がるか、あるいは沸点が何K上がるかは、溶かした溶質の物質量に比例し、溶媒の質量に反比例する、ということを表しています。
この式はある意味当然のことを表しています。
なぜなら溶媒に溶質をたくさんとかした方が邪魔となる粒子が増えるということなので、それだけ凝固点は下がり、沸点は上昇します。また、溶媒がたくさんある方が溶質の影響は小さくなります。そのためこの式が成り立つのです。
凝固点降下・沸点上昇の問題を解く上で注意すること
それでは問題を解く上での注意点を2つ確認します。
注意点①:質量モル濃度の分母は溶媒
まず1つ目は、質量モル濃度の分母は溶媒であるということです。
つまり、2つ目の計算公式で言えば、Wの部分が溶液ではなく溶媒であるということです。モル濃度や質量パーセント濃度では分母は溶液となっています。しかし、質量モル濃度の分母は溶媒です。
ではなぜ溶液ではなく溶媒なのでしょうか。この理由は、希薄溶液のとき、これらの計算公式が正確に成り立つからです。逆に言うと希薄溶液でなければ、これらの式は正確には成り立ちません。
希薄溶液とはその名の通り、濃度の薄い溶液のことで、下図のように多量の溶媒に少量の溶質が混ざっている溶液のことです。この状況であれば比例関係が正確に成り立ちます。
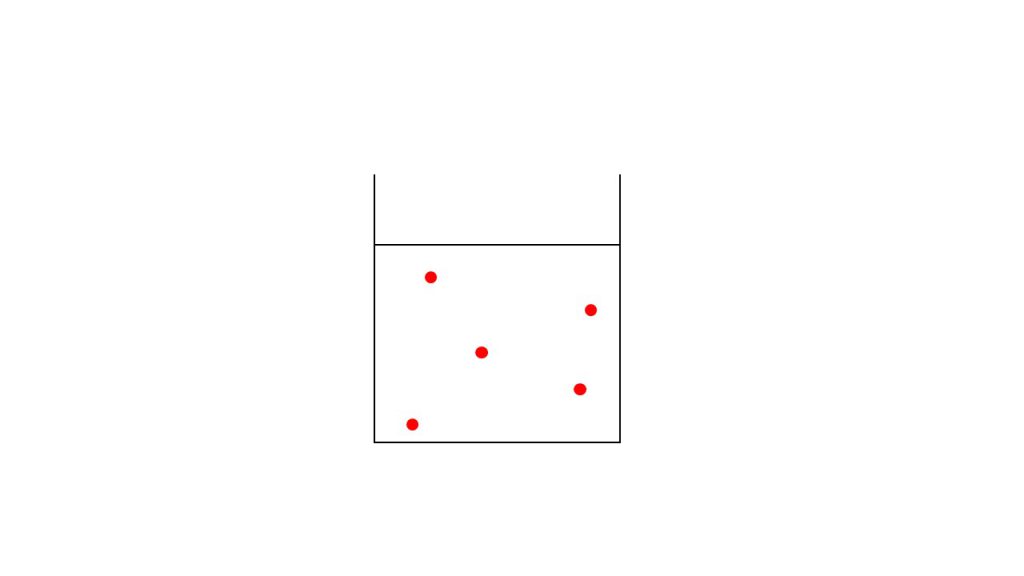
希薄溶液は溶媒の量に対して溶質の量がとても少ないので、溶液の量と溶媒の量はほとんど同じものとなります。たとえ溶質によるとても小さな量の変化を厳密に測定したとしても、実際計算するときは、そのわずかな量の変化は誤差として四捨五入で切り捨てられてしまいます。
それであれば、準備の段階で正確に量を測定している溶媒を最初から使った方がよいということで、質量モル濃度の分母は溶媒となっているのです。
とにかく重要なのは、これらの問題を解いているときに対象としている溶液は希薄溶液であるということを意識することです。
なぜ希薄溶液なのか
しかし、そうなってくると、このことに関してもう一つ疑問が浮かんでくると思います。ではなぜ希薄溶液のとき、この式が正確に成り立つのかという疑問です。
それは希薄溶液であれば分子間力といった溶質どうしの相互作用や、溶質自体の体積を無視することができるからです。
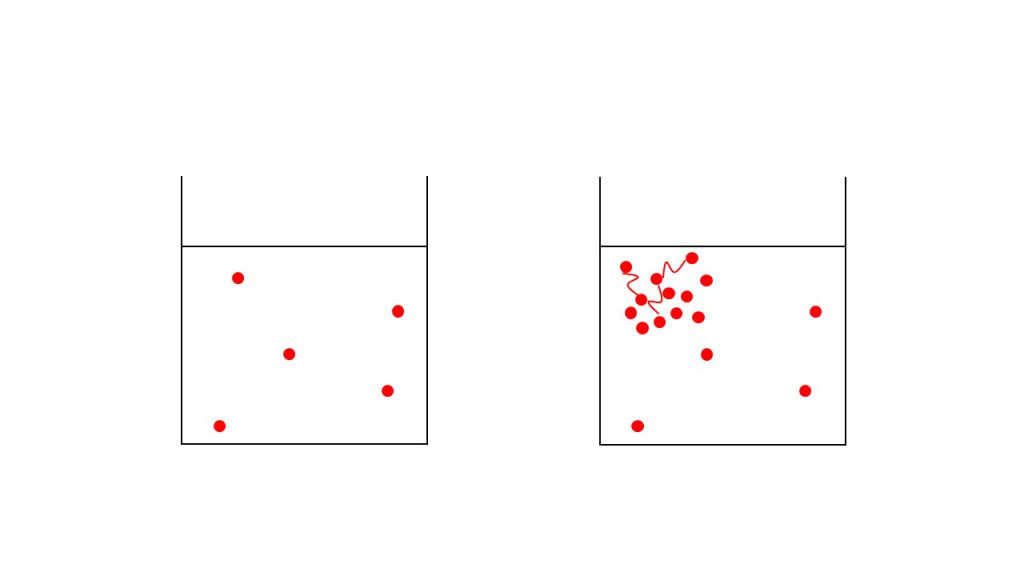
上図の左のように多量の溶媒の中にぽつりぽつりと溶質がある状況だと、溶質どうしお互いに影響し合うことはほとんどありません。また溶媒に対して溶質の量がとても少ないので、溶質自体の大きさは無視しても問題ありません。そのため、きれいに比例関係が成り立つのです。
逆に上図の右のように溶質がたくさん入っている状況だと、溶質どうしの相互作用が働き、さらに溶質自体の量を無視することができなくなります。こうなると綺麗な比例関係は成り立たなくなるのです。
こういった話はどこかで聞いた覚えはないでしょうか。
これは理想気体の条件と同じなのです。理想気体とは、気体分子どうしの分子間力が働かず、気体分子自体の大きさを無視した気体のことです。
そして、こういった条件であれば、
pV=nRT
の状態方程式が正確に成り立ちます。
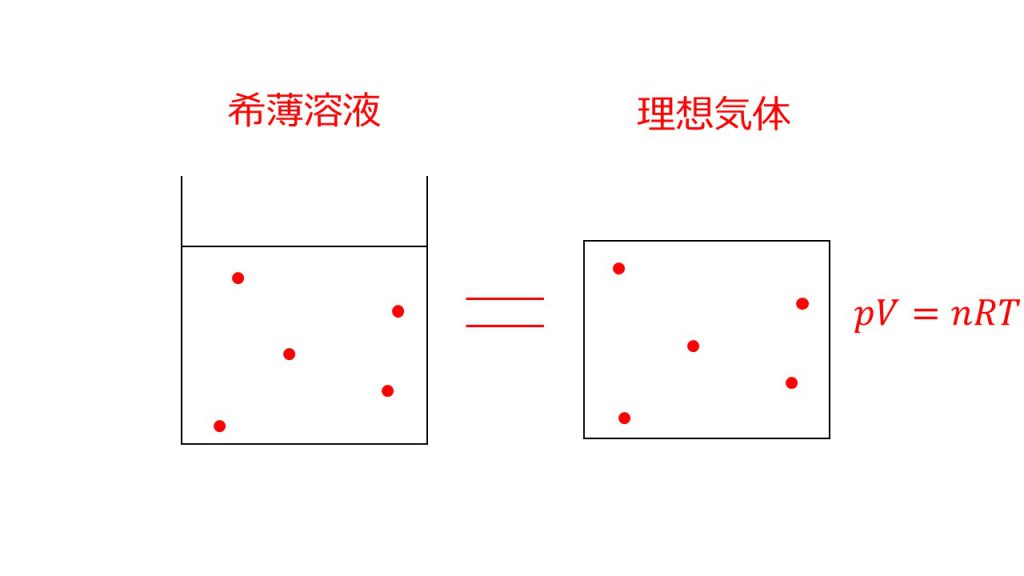
希薄溶液は多量の溶媒の中に少量の溶質がぽつりぽつりと存在している、理想気体は広い空間の中に気体分子がぽつりぽつりと存在している。
このように希薄溶液と理想気体は同じ状況をつくっているのです。このことはとても重要なので知っておきましょう。
- 理想気体の状態方程式の使い方(理想気体とは何か、混合気体の考え方、計算の工夫の仕方についても解説しています)
- 浸透圧の解説(なぜ浸透圧の式と理想気体の状態方程式が同じ式になるのかについても解説しています)
注意点②:溶質は粒子であれば何でもいい
それでは2つ目の注意点を確認します。
2つ目の注意点は、溶質は粒子であれば何でもよいということです。
つまり、2つ目の計算公式のnは、分子やイオンなど溶液に含まれている粒子の総物質量であるということです。特にイオンの物質量をnに加えるということは、よく問われるので必ず覚えておきましょう。
例えば溶媒にNaClを0.1mol溶かしたとき、このnは0.1molではなくて、nは0.2molとなります。なぜならNaClは電解質の塩なので、水溶液中で必ずNa+とCl-に電離します。そのためNaClを0.1mol溶かした場合は、Na+が0.1mol 、Cl-が0.1mol出るので、合わせて0.2molの溶質粒子が溶液の中に存在するということになるのです。
この「粒子の種類は関係ない」という話は理想気体でもありました。状態方程式のnは、気体の種類に関係なく、気体分子の物質量を代入します。
ここでも希薄溶液と理想気体のつながりが見えます。
ちなみにこのように、溶質の種類は何でもよいので、この比例定数(モル凝固点降下・モル沸点上昇)は溶媒に固有の値となります。「溶媒が何であるか」だけが凝固点降下度あるいは沸点上昇度に関係するのです。
- 浸透圧も溶質は何でもいいです→浸透圧の解説(なぜ浸透圧の式と理想気体の状態方程式が同じ式になるのかについても解説しています)
例題①:凝固点降下度から分子量を求める
それでは凝固点降下や沸点上昇使った問題を解いてみます。まずは以下の問題を解きます。
水100gにショ糖2.28gを溶かすと凝固点は-0.124度であった。水のモル凝固点降下を1.86としてショ糖の分子量を求めてみましょう。
凝固点降下や沸点上昇の計算問題は、基本的に計算公式に代入していけば解けます。

まずは求める分子量をMとして、計算公式を使って方程式を作っていきます。
方程式を立てる
左辺は凝固点降下度、つまり溶媒の本来の凝固点から何K凝固点が下がったかを表すので、絶対値をつけるなどして正の値となるようにします。
そして右辺ですが、まずは比例定数である水のモル凝固点降下の1.86を代入し、次に溶質の物質量を代入します。今回ショ糖は非電解質なので電離を考える必要はありません。そのためnの部分は、ショ糖の質量をショ糖のモル質量で割り、ショ糖つまり溶質の物質量となります。そして、溶媒の質量が100gなので×10-3することで溶媒のキログラムとし、それを分母に書きます。
これで方程式ができたのであとは計算していきます。
工夫しながら方程式を解く
まずは求めたい文字だけを左辺にもっていき、それ以外を右辺に集めます。
今回みたいに小数点が面倒くさい場合は、小数点を外に出しておくと計算がしやすくなります。分母で言えば、小数点を3つ動かすので、10-3を外に出して10-1乗と合わせて10-4とします。分子は1.86で小数点を2つ動かし、2.28でも小数点を2つ動かすので合わせて10-4を外に出します。
このようにしてからできるだけ約分をしていきます。まずは10-4を約分し、4で約分します。すると186が31×6だということに気づけば、さらに約分ができます。よって6×57となるので、答えは342となります。
分子量や原子量を答えるときは単位を書かないように注意しましょう。
このように凝固点降下や沸点上昇の計算題は、計算公式を使って方程式を立てると解くことができます。
例題②:溶質が電解質のとき
それでは次はこの問題を解きます。
以下の3つの水溶液を沸点の高い順に並べます。
a:水100gにブドウ糖(C6H12O6)1gを溶かした溶液。
b:水100gに臭化ナトリウム1gを溶かした溶液。
c:水100gに塩化カルシウム1gを溶かした溶液。
ただし原子量はH=1, C=12, O=16, Na=23, Cl=35.5, Ca=40, Br=80します。
溶媒に溶質を加えているので、それぞれ沸点上昇が起きます。このとき、沸点がどのようになるのかを考えてみましょう。
よくある間違い
まずはよくある間違いを示します。
C6H12O6の分子量が180で、NaBrの式量が103で、CaCl2の式量が111なのでそれぞれの沸点上昇度を以下のような式で表すと、間違いとなっててしまいます。

なぜならグルコースなどC6H12O6は非電解質なので水溶液中で電離することはありませんが、臭化ナトリウムや塩化カルシウムといった塩は基本的に水溶液中で100%電離する電解質だからです。
そのため、発生するイオンを考えないといけないので、Δtb, Δtaの2つの式が間違いということになります。
正しい答案(溶質の電離を考慮する)
それでは正解を解説します。
NaBrは水溶液中でNa+とbr-に電離し、CaCl2は水溶液中でCa2+と2Cl-に電離します。つまり1mol のNaBrを溶かした場合、溶質となるイオンが合計2molできるということであり、CaCl2を1mol溶かした場合は溶質となるイオンが合計3molできるということになります。
そのため、水溶液a, b, cの沸点上昇度をそれぞれΔta, Δtb, Δtcとし、水のモル沸点上昇をkとおくと、以下の式が立てられます。
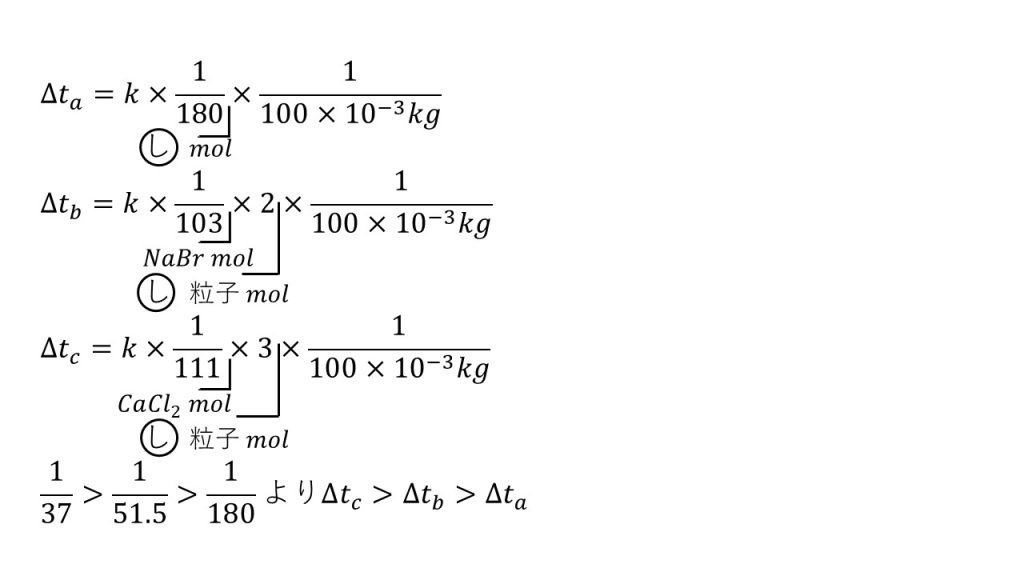
ポイントは×2と×3です。
つまり、1/103はNaBrの物質量であり、それに×2をすることで溶質粒子の物質量となります。cも同様に、1/111がCaCl2の物質量であり、それに×3をすることで溶質粒子の物質量となります。
このように電解質の凝固点降下や沸点上昇を考えるときは、溶質粒子の物質量になるように注意しましょう。
なるべく計算をせずに大小関係を比較する
あとはこの3つを比べて、大きい順に並べていきます。
今回これらを比べるときのポイントは、全て計算するのではなく溶質の物質量だけが違うので、その部分だけを比べます。1/111×3が1/37で、1/103×2が1/51.5なので、溶質粒子の物質量の大きい順は1/37>1/51.5>1/180になります。
分数を比べるときは、分母か分子をそろえるようにすると比べやすくなります。
よって答えはc>b>aの順番で水溶液の沸点が高くなります。
いかがだったでしょうか。今回の解説で凝固点降下と沸点上昇の基本的な考え方は理解できたと思います。あとはそれが身に付くまで問題演習をしてください。
(3)解説授業の内容を復習しよう
(4)希薄溶液(凝固点降下、沸点上昇、浸透圧)の解説
①凝固点降下・沸点上昇(なぜ質量モル濃度の分母が溶媒なのか、計算における注意点についても解説しています)
④浸透圧の解説(なぜ浸透圧の式と理想気体の状態方程式が同じ式になるのかについても解説しています)
☆おまけ:希薄溶液と気体の類似性(ファント・ホッフ「第1回ノーベル化学賞受賞記念講演」より抜粋)
(5)参考
☆化学の解説動画・授業動画一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学知識テスト一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学の解説・授業・知識・演習問題一覧(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
☆化学の語呂合わせ(化学基礎・理論化学・無機化学・有機化学・高分子化合物)
「化学計算の王道」シリーズは『思考訓練の場としての体系化学』(GHS予備校)を参考にしています。
GHS予備校についてはこちら→https://ghs-yobikou.co.jp/
思考訓練シリーズの購入はこちら→https://ghs-yobikou.shop/
